
【题目】A+、B2+、C-、D2-4种离子具有相同的电子层结构。现有以下排列顺序:
①B2+>A+>C->D2-②C->D2->A+>B2+③B2+>A+>D2->C-④D2->C->A+>B2+4种离子的半径由大到小以及4种元素原子序数由大到小的顺序分别是( )
A.①④B.④①C.②③D.③②
科目:高中化学 来源: 题型:
【题目】草酸(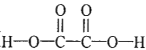 )在工业上可作漂白剂、鞣革剂,也是实验室常用试剂。
)在工业上可作漂白剂、鞣革剂,也是实验室常用试剂。
(1)已知草酸中相关化学键的键能数据如下表:

一定条件下发生反应H2C2O4(g) ![]() H2O(g)+CO(g)+CO2(g) △H=_________kJ/mol。
H2O(g)+CO(g)+CO2(g) △H=_________kJ/mol。
(2)现将0.50mol无水草酸放入10L的密闭容器中,分别在T1、T2时进行上述反应(体系内物质均为气态),测得n(H2C2O4)随时间变化的数据如下表:

①温度:T1_________T2(填“>”、“<”或“=”);
②T2时0~20min平均反应速率v(CO)= _________;
③该反应达到平衡的标志为_________ (填序号);
a消耗H2C2O4和生成H2O的物质的量相等 b.气体密度不变
c混合气体的平均摩尔质量不变 d.体系中![]() 不变
不变
④T2时,反应至20min时再加入0.5molH2C2O4,反应达平衡时H2C2O4物质的量_________0.36mol(填“>”“<”或“=”)。
(3)室温下利用H2C2O4溶液和酸性KMnO4溶液的反应探究外界条件对反应速率的影响,设计方案如下:

①上述反应的离子方程式为_________;
②分析数据可得到的结论是_________;
③该实验中若n(Mn2+)随时间变化趋势如图一所示,请于图二画出t2 后生成CO2的速率图像(从a点开始作图)并说明理由_________。
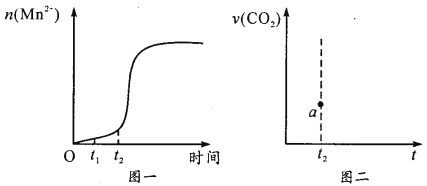 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.3p2表示3p能级上有2个电子
B.处于最低能量的原子叫做基态原子
C.同一原子中,3s、3p、3d、4s 能级的能量逐渐增大
D.同一原子中,3s、3p、3d能级的轨道数依次增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅的叙述正确的是
A.硅在常温下能跟氧气发生化合反应
B.硅是组成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位
C.硅的化学性质不活泼,在常温下不与任何物质反应
D.硅在电子工业中是重要的半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O)晶体,设计了如下流程:

已知:(1)常温下,金属离子开始沉淀和沉淀完全时的pH 见下表。
开始形成氢氧化物沉淀的pH | 完全形成氢氧化物沉淀的pH | |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.2 |
Al3+ | 3.3 | 5.0 |
(2)七水合硫酸亚铁(FeSO4·7H2O)的溶解度
温度/℃ | 10 | 20 | 30 | 40 | 50 |
FeSO4·7H2O溶解度(g) | 15.5 | 26.5 | 32.9 | 40.2 | 48.9 |
(1)溶解烧渣选用足量硫酸,写出Fe2O3与硫酸反应的离子方程式_______________;检验溶液1中含有Fe3+的实验方法是___________________;
(2)固体1是制作单晶硅的主要原料,写出该反应的化学方程式___________________;
(3)试剂X是__________________;固体2是___________________;
(4)加入NaOH溶液控制pH应不超过_________________;
(5)从溶液2中获得晶体的的方法为______________, _____________过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧是人类最早利用的化学反应之一,人类已有几十万年的利用燃烧反应的历史,燃烧需要具备的条件是( )
①可燃物 ②氧气(空气等助燃剂) ③温度达到着火点
A.①②B.②③C.①③D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强 合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中 制备金属钼的主要流程图。
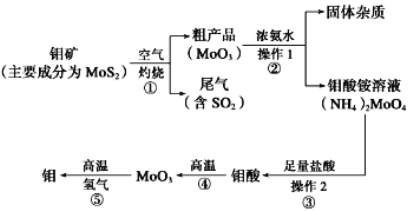
(1)写出在高温下发生反应①的化学方程_________________________________________
(2)生产中用足量的浓氨水吸收反应①的尾气合成肥料,写出该反应的离子方程式:______________________________
(3)如果在实验室模拟操作 1 和操作 2,则需要使用的主要玻璃仪器有______________________________
(4)某同学利用下图所示装置来制备氢气,利用氢气还原三氧化钼,根据要求回答问题:
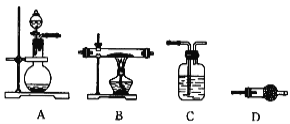
① 请设计一个实验方案验证H2的还原性并检验其氧化产物,其装置连接顺序是______________________________
② 在烧瓶 A 中加入少量硫酸铜的目的是_____
③ 两次使用 D 装置,其中所盛的药品依次是_____、_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1.0L密闭容器中放入0.10 molA(g),在一定温度进行如下反应:A(g) ![]() B(g)+C(g)△H=+85.1kJmol-1,反应时间(t)与容器内气体总压强(p)的数据见下表:
B(g)+C(g)△H=+85.1kJmol-1,反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为 ______ 。
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为 ______,平衡时A的转化率为 ______。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总= ______ mol,n(A)= ______ mol。
②下表为反应物A浓度与反应时间的数据,计算:α= ______。
反应时间t/h | 0 | 4 | 8 | 16 |
c(A)/(molL-1)) | 0.10 | a | 0.026 | 0.0065 |
分析该反应中反应物的浓度c(A)变化与时间间隔(△t)的规律,得出的结论是 ______,由此规律推出反应在12h时反应物的浓度c(A)为 ______ mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com