
【题目】在1.0L密闭容器中放入0.10 molA(g),在一定温度进行如下反应:A(g) ![]() B(g)+C(g)△H=+85.1kJmol-1,反应时间(t)与容器内气体总压强(p)的数据见下表:
B(g)+C(g)△H=+85.1kJmol-1,反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为 ______ 。
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为 ______,平衡时A的转化率为 ______。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总= ______ mol,n(A)= ______ mol。
②下表为反应物A浓度与反应时间的数据,计算:α= ______。
反应时间t/h | 0 | 4 | 8 | 16 |
c(A)/(molL-1)) | 0.10 | a | 0.026 | 0.0065 |
分析该反应中反应物的浓度c(A)变化与时间间隔(△t)的规律,得出的结论是 ______,由此规律推出反应在12h时反应物的浓度c(A)为 ______ mol·L-1。
【答案】(1)升高温度、降低压强
(2)α(A)="("![]() -1)100%;94.1%;
-1)100%;94.1%;
(3)①0.1![]() ;0.1(2-
;0.1(2-![]() );
);
②0.051(1分);每间隔4小时,A的浓度为原来的一半。0.013(1分)
【解析】
试题(1) 欲提高A的平衡转化率即让此反应向正反应方向移动。此反应是吸热反应,升高温度,平衡向正方向移动;此反应是气体分子数增大的反应,降低压强,平衡向分子数减少的方向即正方向移动。
(2) 在相同条件下,压强之比等于物质的量之比。在此反应中 A(g)![]() B(g)+C(g),P/P0=n/n0,n与n0分别为气体总物质的量和起始时气体的物质的量,在反应中增加的物质的量和反应的A的物质的量相等,所以A的转化率为(n-n0)/n0100%=" (P-" P0)/P0100%="("
B(g)+C(g),P/P0=n/n0,n与n0分别为气体总物质的量和起始时气体的物质的量,在反应中增加的物质的量和反应的A的物质的量相等,所以A的转化率为(n-n0)/n0100%=" (P-" P0)/P0100%="("![]() -1)100%;平衡时A的转化率为(9.53-4.91)/4.91
-1)100%;平衡时A的转化率为(9.53-4.91)/4.91
=94.1%。
①起始时在1.0 L密闭容器中放入0.10molA(g),n总=" n(A)+" n(A)×α(A)=" n(A)×(1+α(A))=" 0.1![]() mol,n(A)= 0.1(2-
mol,n(A)= 0.1(2-![]() )mol。
)mol。
②对照反应时间和反应物A的浓度的关系即可得到。


科目:高中化学 来源: 题型:
【题目】A+、B2+、C-、D2-4种离子具有相同的电子层结构。现有以下排列顺序:
①B2+>A+>C->D2-②C->D2->A+>B2+③B2+>A+>D2->C-④D2->C->A+>B2+4种离子的半径由大到小以及4种元素原子序数由大到小的顺序分别是( )
A.①④B.④①C.②③D.③②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某酸HA的电离常数Ka=2.0×10-8,用2mol/LNaOH溶液滴定100ml2mol/LHA溶液,溶液的pH随滴入NaOH溶液的体积变化曲线如图![]() 下列说法正确的是
下列说法正确的是

A. a点溶液的pH=4
B. b点溶液中存在:c(A-)>c(Na+)>c(H+)=c(OH-)
C. b点c(HA)/c(A-)=5
D. c点c(A-)+c(H+)=c(Na+)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】干燥剂的干燥性能可用干燥干燥效率(1立方米空气中实际余留水蒸气的质量![]() 来衡量
来衡量![]() 某些干燥剂的干燥效率如下:
某些干燥剂的干燥效率如下:
物质 | MgO | CaO | ZnCl2 | ZnBr2 |
干燥效率 | 0.008 | 0.2 | 0.8 | 1.1 |
根据以上数据,有关叙述错误的是
A. MgO的干燥性能比CaO差 B. 干燥效率可能与干燥剂的阴阳离子半径大小有关
C. MgCl2可能是比CaCl2更好的干燥剂 D. 上述干燥剂中阳离子对干燥性能的影响比阴离子大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一般情况下,前者无法决定后者的是
A.原子核外电子排布﹣﹣元素在周期表中的位置
B.硝酸具有强氧化性﹣﹣铜单质易溶于浓硝酸
C.分子间作用力的大小﹣﹣分子稳定性的高低
D.二氧化硫具有还原性﹣﹣二氧化硫能使高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g)![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
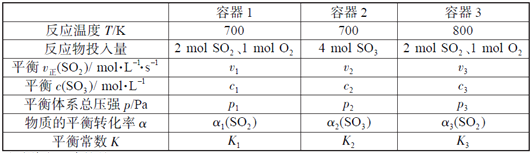
下列说法正确的是( )
A. v1< v2,c2< 2c1 B. K1> K3,p2> 2p3
C. v1< v3,α1(SO2 ) >α3(SO2 ) D. c2> 2c3,α2(SO3 )+α3(SO2 )=1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A. K2FeO4可代替Cl2处理饮用水,有杀菌消毒作用
B. CaO2属于碱性氧化物,也属于离子化合物,其阴阳离子个数比为1:2
C. 浸泡过高锰酸钾溶液的硅藻土放于新鲜的水果箱内是为了保鲜水果
D. 高温下可用金属钠还原四氯化钛来制取金属钛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中Y形管是一种特殊的仪器,通常与其他仪器组合可以进行某些实验探究。利用下图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。回答下列问题:

(1)广口瓶中间那根玻璃管的作用是:__________________________________________。
(2)实验前需要将BaCl2溶液煮沸,其目的是:_________________________________。
(3)甲中发生反应的化学方程式为:____________________________________________。
(4)乙中分别加入一种常用氧化物和一种无色液体,常温下将两者混合可产生一种碱性气体。该反应的化学方程式为:____________________________________________。
(5)实验时,先使甲中产生的足量气体通入BaCl2溶液中,始终无沉淀生成。由此得出的结论是_______。
(6)向上述⑸实验所得溶液中通入乙产生的气体,产生白色沉淀,请写出发生反应的离子方程式:_____。
(7) 请指出该实验的一个不足之处:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的短周期元素,已知A、B、D三种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4。
(1)写出下列元素符号: B________,D________。
(2)A与D两元素可形成化合物,用电子式表示其化合物的形成过程:________。
(3)A在空气中燃烧生成原子个数比为1:1的化合物,写出其电子式为________。
(4)元素C的最高价氧化物与元素A的最高价氧化物的水化物反应的离子方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com