
【题目】一般情况下,前者无法决定后者的是
A.原子核外电子排布﹣﹣元素在周期表中的位置
B.硝酸具有强氧化性﹣﹣铜单质易溶于浓硝酸
C.分子间作用力的大小﹣﹣分子稳定性的高低
D.二氧化硫具有还原性﹣﹣二氧化硫能使高锰酸钾溶液褪色
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O)晶体,设计了如下流程:

已知:(1)常温下,金属离子开始沉淀和沉淀完全时的pH 见下表。
开始形成氢氧化物沉淀的pH | 完全形成氢氧化物沉淀的pH | |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.2 |
Al3+ | 3.3 | 5.0 |
(2)七水合硫酸亚铁(FeSO4·7H2O)的溶解度
温度/℃ | 10 | 20 | 30 | 40 | 50 |
FeSO4·7H2O溶解度(g) | 15.5 | 26.5 | 32.9 | 40.2 | 48.9 |
(1)溶解烧渣选用足量硫酸,写出Fe2O3与硫酸反应的离子方程式_______________;检验溶液1中含有Fe3+的实验方法是___________________;
(2)固体1是制作单晶硅的主要原料,写出该反应的化学方程式___________________;
(3)试剂X是__________________;固体2是___________________;
(4)加入NaOH溶液控制pH应不超过_________________;
(5)从溶液2中获得晶体的的方法为______________, _____________过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤脱硫可减少SO2尾气的排放,燃煤脱硫技术受到各界科研人员的关注。一种燃煤脱硫技术的原理是:CaO(s)+3CO(g)+SO2(g)![]() CaS(s)+3CO2(g) △H=-394.0kJ/mol。保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度):
CaS(s)+3CO2(g) △H=-394.0kJ/mol。保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度):
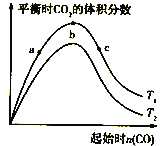
下列有关说法正确的是
A. T1比T2高 B. b点SO2转化率最高
C. b点后曲线下降是因CO体积分数升高 D. 减小压强可提高CO、SO2转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重金属离子具有毒性,强碱性溶液不能直接排放到自然界中。实验室中有甲、乙两种废液,甲废液经化验呈碱性,主要有毒离子为Ba2+。如将甲、乙两废液按一定比例混合,毒性明显降低,且可排放到自然界中。则乙废液中可能含有的离子是
A. K+和SO42- B. Cu2+和Cl-
C. Cu2+和SO42- D. Cu2+和CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.在非标准状况下,1mol任何气体的体积不可能是22.4L
B.同温同压下两种气体,只要它们的分子数相同,所占体积几乎相同
C.在标准状况下,体积为22.4L的物质都是1mol
D.1mol任何气体的体积一定是22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1.0L密闭容器中放入0.10 molA(g),在一定温度进行如下反应:A(g) ![]() B(g)+C(g)△H=+85.1kJmol-1,反应时间(t)与容器内气体总压强(p)的数据见下表:
B(g)+C(g)△H=+85.1kJmol-1,反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为 ______ 。
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为 ______,平衡时A的转化率为 ______。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总= ______ mol,n(A)= ______ mol。
②下表为反应物A浓度与反应时间的数据,计算:α= ______。
反应时间t/h | 0 | 4 | 8 | 16 |
c(A)/(molL-1)) | 0.10 | a | 0.026 | 0.0065 |
分析该反应中反应物的浓度c(A)变化与时间间隔(△t)的规律,得出的结论是 ______,由此规律推出反应在12h时反应物的浓度c(A)为 ______ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组依据反应:SO2(g)+Cl2(g)![]() SO2Cl2(g)△H<0,设计制备磺酰氯SO2Cl2的装置如图:
SO2Cl2(g)△H<0,设计制备磺酰氯SO2Cl2的装置如图:

有关信息如表所示:
SO2Cl2 | Cl2 | SO2 | |
熔点/℃ | -54.1 | -101 | -72.4 |
沸点/℃ | 69.1 | -34.6 | -10 |
性质 | 遇水发生剧烈水解 | / | / |
(1)若用浓盐酸与二氧化锰为原料制取Cl2,反应的化学方程式为 ______。
(2)B仪器的作用是 ______。
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择 ______。
a.冰水浴 b.常温 c.加热至69.1℃
(4)如果通入的Cl2或SO2含有水蒸气,氯气和二氧化硫可能发生反应的化学方程式为 ______ .
(5)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应.充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收。分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W。
①经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式_________________。
②无色溶液W中的阴离子除含少量OH-外,还含有其它两种阴离子,检验溶液W中这两种阴离子方法是______。
③反应完成后,在W溶液、烧杯中分别滴加过量的BaCl2溶液,均出现白色沉淀,此沉淀不溶于稀盐酸,经过滤、洗涤、干燥,称量得到的固体质量分别为Xg、Yg,计算SO2+Cl2![]() SO2Cl2反应中,SO2的转化率为_____(用含X、Y的代数式表示)。
SO2Cl2反应中,SO2的转化率为_____(用含X、Y的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 利用丁达尔效应可区分蛋白质溶液与葡萄糖溶液
B. 某物质经科学测定只含有一种元素,则可以断定该物质是一种纯净物
C. 用过滤法无法除去Fe(OH)3胶体中的FeCl3
D. 向豆浆中加入硫酸钙制豆腐,是利用了胶体的聚沉性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中充入一定量NO2,发生反应2NO2(g) ![]() N2O4(g) ΔH=-57 kJ· mol-1。在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是
N2O4(g) ΔH=-57 kJ· mol-1。在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是
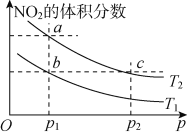
A. a、c两点的反应速率:a>c
B. a、b两点NO2的转化率:a<b
C. a、c两点气体的颜色:a深,c浅
D. 由a点到b点,可以用加热的方法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com