
����Ŀ��ijѧϰС�����ݷ�Ӧ��SO2��g��+Cl2��g��![]() SO2Cl2��g����H<0������Ʊ�������SO2Cl2��װ����ͼ��
SO2Cl2��g����H<0������Ʊ�������SO2Cl2��װ����ͼ��

�й���Ϣ�����ʾ��
SO2Cl2 | Cl2 | SO2 | |
�۵�/�� | -54.1 | -101 | -72.4 |
�е�/�� | 69.1 | -34.6 | -10 |
���� | ��ˮ��������ˮ�� | / | / |
(1)����Ũ�������������Ϊԭ����ȡCl2����Ӧ�Ļ�ѧ����ʽΪ ______��
(2)B������������ ______��
(3)Ϊ�˱��ڻ����ķ�������߷�Ӧ���ת���ʣ�Aװ�õķ�Ӧ�������ѡ�� ______��
a.��ˮԡ b.���� c.������69.1��
(4)���ͨ���Cl2��SO2����ˮ�����������Ͷ���������ܷ�����Ӧ�Ļ�ѧ����ʽΪ ______ ��
(5)ʵ��ʱ��ͨ������Cl2��Aװ���еĿ������ߣ��ٻ���ͨ������SO2����������Ӧ����ַ�Ӧ����ͨ��Cl2ʹװ���е�SO2�����ձ��б����ա������������õ�SO2Cl2�м�ˮ�����ְ����������õõ���ɫ��ҺW��
�پ�����SO2Cl2��H2O��Ӧ���ڷ�������ԭ��Ӧ��д���÷�Ӧ�Ļ�ѧ����ʽ_________________��
����ɫ��ҺW�е������ӳ�������OH-�⣬�������������������ӣ�������ҺW�������������ӷ�����______��
�۷�Ӧ��ɺ���W��Һ���ձ��зֱ�μӹ�����BaCl2��Һ�������ְ�ɫ�������˳���������ϡ���ᣬ�����ˡ�ϴ�ӡ���������õ��Ĺ��������ֱ�ΪXg��Yg������SO2+Cl2![]() SO2Cl2��Ӧ�У�SO2��ת����Ϊ_____(�ú�X��Y�Ĵ���ʽ��ʾ)��
SO2Cl2��Ӧ�У�SO2��ת����Ϊ_____(�ú�X��Y�Ĵ���ʽ��ʾ)��
���𰸡���1��MnO2+ 4HCl��Ũ��![]() MnCl2+ Cl2��+ 2H2O
MnCl2+ Cl2��+ 2H2O
��2������SO2Cl2��3��a
��4��SO2+Cl2+2H2O![]() H2SO4+2HCl
H2SO4+2HCl
��5���� SO2Cl2��2H2O![]() H2SO4��2HCl
H2SO4��2HCl
��ȡ����W��Һ���Թ��У��������Ba(NO3)2��Һ���в�����ϡ����İ�ɫ����������˵����Һ�к���SO42�����ˣ�����Һ�еμ�HNO3�ữ���ټ���AgNO3��Һ��������ɫ��������˵����Һ����Cl
��6��![]()
��������
������ͼȷ��B�����������ã�Ϊ�˱������ʵķ��룬�������������ʵ��۷е㣬��ƽ��Ƕȣ��¶�Խ��Խ������SO2Cl2���ɣ�ѡ���ˮԡ�����ڷ���SO2Cl2����5��ͨ���SO2������ת��ΪSO2Cl2�����ֱ���Һ���գ����SO2Cl2�����ʣ���ˮ��Ӧ�ķ���ʽ��ʾΪSO2Cl2��2H2O![]() H2SO4��2HCl������W��Һ�г��˻���OH-,������Cl-��SO42-������ķ���Ϊ��ȡ����W��Һ���Թ��У��������Ba(NO3)2��Һ���в�����ϡ����İ�ɫ����������˵����Һ�к���SO42�����ˣ�����Һ�еμ�HNO3�ữ���ټ���AgNO3��Һ��������ɫ��������˵����Һ����Cl����W��Һ���ձ�����Һ�μӹ�����BaCl2��Һ��������BaSO4��������Ԫ���غ㣬SO2Cl2��S��ȫת��ΪBaSO4����ϵΪS ~ BaSO4���ձ��е�SO2�ȱ���������ΪSO42-,��ת��ΪBaSO4����ϵ��ΪS
H2SO4��2HCl������W��Һ�г��˻���OH-,������Cl-��SO42-������ķ���Ϊ��ȡ����W��Һ���Թ��У��������Ba(NO3)2��Һ���в�����ϡ����İ�ɫ����������˵����Һ�к���SO42�����ˣ�����Һ�еμ�HNO3�ữ���ټ���AgNO3��Һ��������ɫ��������˵����Һ����Cl����W��Һ���ձ�����Һ�μӹ�����BaCl2��Һ��������BaSO4��������Ԫ���غ㣬SO2Cl2��S��ȫת��ΪBaSO4����ϵΪS ~ BaSO4���ձ��е�SO2�ȱ���������ΪSO42-,��ת��ΪBaSO4����ϵ��ΪS![]() BaSO4������SO2������Ϊ(X+Y)/233g/mol,ת��ΪSO2Cl2��SO2����ΪX/233g/mol,����������ת����Ϊ
BaSO4������SO2������Ϊ(X+Y)/233g/mol,ת��ΪSO2Cl2��SO2����ΪX/233g/mol,����������ת����Ϊ![]() ��
��


 ���Ž�������С״Ԫϵ�д�
���Ž�������С״Ԫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ũ�Ⱦ�Ϊ3mol��L-1������������100mL���ֱ�����������Fe�ۣ���Ӧ��Ϻ��������������֮��Ϊ3��4������������е����۵�����Ϊ
A. 5.6g B. 8.4g C. 11.2g D. 16.8g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ӧ�úʹ������Ļ��������������������Ҫ���塣
��1������[CO(NH2)2]��һ�ָ�Ч���ʣ�Ҳ��һ�ֻ���ԭ�ϡ�
��������Ϊԭ����һ�������·�����Ӧ��CO(NH2)2 (s) + H2O(l)![]() 2 NH3(g)+CO2(g) ��H��+133.6 kJ/mol���÷�Ӧ�Ļ�ѧƽ�ⳣ���ı���ʽK�� �����ڸ÷�Ӧ������˵����ȷ���� ������ţ���
2 NH3(g)+CO2(g) ��H��+133.6 kJ/mol���÷�Ӧ�Ļ�ѧƽ�ⳣ���ı���ʽK�� �����ڸ÷�Ӧ������˵����ȷ���� ������ţ���
a. �ӷ�Ӧ��ʼ��ƽ��ʱ�����л�������ƽ����Է����������ֲ���
b. ��ƽ����ϵ������ˮ��������ʹ�÷�Ӧ��ƽ�ⳣ������
c. �����¶�ʹ���ص�ת��������
��������һ�������¿ɽ����������ﻹԭΪ������
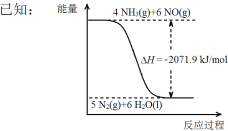
��Ϣ�����Ϣ�����ػ�ԭNO(g)���Ȼ�ѧ����ʽ�� ��
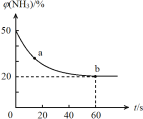
���ܱ��������Ե����ʵ�����NH3��CO2Ϊԭ������120 �桢���������·�Ӧ�������أ�CO2(g) +2NH3(g)![]() CO (NH2)2 (s) +H2O(g)�����������NH3�����ʵ����ٷֺ���[�գ�NH3��]��ʱ��仯��ϵ��ͼ��ʾ����a�������Ӧ����v����CO2�� b����淴Ӧ����v���棩��CO2�����>������=����<������������ƽ��ת������ ��
CO (NH2)2 (s) +H2O(g)�����������NH3�����ʵ����ٷֺ���[�գ�NH3��]��ʱ��仯��ϵ��ͼ��ʾ����a�������Ӧ����v����CO2�� b����淴Ӧ����v���棩��CO2�����>������=����<������������ƽ��ת������ ��
��2��NO2����Ⱦ����������Na2CO3��Һ����NO2������CO2����֪9.2 g NO2��Na2CO3��Һ��ȫ��Ӧʱת�Ƶ���0.1 mol���˷�Ӧ�����ӷ���ʽ�� ��ǡ�÷�Ӧ��ʹ��Һ�е�CO2��ȫ�ݳ���������Һ�������ԣ�����Һ�д��ڵ���������Ũ�ȴ�С��ϵ��c(Na+)>________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������£�ǰ�����������ߵ���
A.ԭ�Ӻ�������Ų�����Ԫ�������ڱ��е�λ��
B.�������ǿ�����ԩ���ͭ����������Ũ����
C.���Ӽ��������Ĵ�С���������ȶ��Եĸߵ�
D.����������л�ԭ�ԩ�������������ʹ���������Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�����������M��Nͨ���ݻ�ΪVL���ܱ������н��з�Ӧ��M��N�����ʵ�����ʱ��Ĺ�ϵ��ͼ��ʾ������˵����ȷ����( )

A. 0��t2����M��ʾ��ƽ����Ӧ������2/t2��mol��L��1��min��1��
B. t1��t2�������ڵ�ѹǿ��С
C. �÷�Ӧ�ķ���ʽΪN![]() 2M
2M
D. t2��t3ʱ�̵Ļ�������ƽ����Է����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���в���ȷ����
A. K2FeO4�ɴ���Cl2��������ˮ����ɱ����������
B. CaO2���ڼ��������Ҳ�������ӻ�������������Ӹ�����Ϊ1:2
C. ���ݹ����������Һ�Ĺ������������ʵ�ˮ��������Ϊ�˱���ˮ��
D. �����¿��ý����ƻ�ԭ���Ȼ�������ȡ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������M�Ƕ�����Ȳ��Һ�����ϵ�һ�֣���Ķ�����Ȳ�������![]() ���Ի�Ϊͬϵ��ĵ�ȡ������A��GΪԭ�Ϻϳ�M��һ��·�ߣ����ַ�Ӧ������ȥ�����£�
���Ի�Ϊͬϵ��ĵ�ȡ������A��GΪԭ�Ϻϳ�M��һ��·�ߣ����ַ�Ӧ������ȥ�����£�
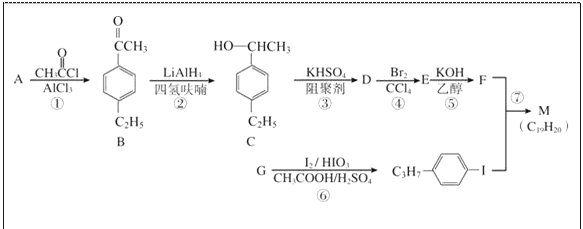
�ش��������⣺
��1��A�ķ���ʽΪ____________��
��2��D�к��еĹ�������____________�������������____________��̼ԭ�ӹ�ƽ�档
��3���ٵķ�Ӧ������____________���۵ķ�Ӧ������____________��
��4���ݵĻ�ѧ����ʽΪ________________________________________________��
��5��B��ͬ���칹������ͬʱ���������������ٱ�����������ȡ���������ܷ���������Ӧ������________�֣������������칹�������к˴Ź�������Ϊ5��壬�ҷ������Ϊ6��2��2��1��1����________��д�ṹ��ʽ����
��6�����������ϳ�·�ߣ����һ���ɱ���ϩ�ͼױ�Ϊ��ʼԭ���Ʊ�![]() �ĺϳ�·�ߣ� _____________��
�ĺϳ�·�ߣ� _____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵����ȷ���ǣ� ��
A.1molN2����3molH2��ȫ��Ӧ����2molNH3
B.����������Ⱦ����Էֽ⣬������ж��а�
C.�������������ཫ̫����ת��Ϊ���ܵij��ò���
D.��ҵ�ϳɰ��Ĺ������˹��̵��Ĺ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡ0.55mol/L��NaOH��Һ50mL��0.25mol/L������50mL������ͼ��ʾ��װ���н����к��ȵIJⶨʵ�顣�ش��������⣺

��1����ͼ��ʵ��װ�ÿ���������ȱ�ٵ�һ�ֲ�����Ʒ��______________������֮�⣬װ���е�һ�����Դ�����_____________________________��
��2��Ϊ��֤��ʵ��ɹ���ͬѧ��ȡ�������ʩ����ͼ������ĭ���ϵ���������____________________________________��
��3��ʵ���������±���
������д�±��еĿհף�
�¶� ʵ����� | ��ʼ�¶�t1������ | ��ֹ�¶�t2������ | �¶Ȳ�ƽ��ֵ (t2��t1)������ | ||
H2SO4 | NaOH | ƽ��ֵ | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ___________ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
�ڽ�����Ϊʵ��������Һ���ܶȶ���1 g/cm3���кͺ���Һ�ı�����c��4.18 J/(g����)������ʵ����д��NaOH��Һ��HCl��Һ��Ӧ���Ȼ�ѧ����ʽ(����������һλС��)��_______________��
������ʵ����ֵ�����57.3 kJ/mol��ƫ�����ƫ���ԭ�������(����ĸ)________��
a��ʵ��װ�ñ��¡�����Ч����
b�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨH2SO4��Һ���¶�
c���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
��4������ú�0.5mol Ba(OH)2��ϡ��Һ������ϡ������Һ��Ӧ����Ӧ�ų�����____57.3 kJ����������������С������������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com