
【题目】铅是一种高密度、柔软的蓝灰色金属。2019年7月23日,铅被列入有害水污染物名录。请回答下列问题。
(1)Pb位于第六周期,与C元素同族。请写出它的外围电子排布式___________,对比以下三种氧化物的熔沸点![]() 、
、![]() 、
、![]() ,从小到大分别为_____________,请解释原因:____________________。
,从小到大分别为_____________,请解释原因:____________________。
(2)铅在自然界主要以方铅矿(PbS)及白铅矿(![]() )的形式存在,也存在于铅矾(
)的形式存在,也存在于铅矾(![]() )中。
)中。![]() 中心原子轨道的杂化类型___________,
中心原子轨道的杂化类型___________,![]() 的空间构型____________。
的空间构型____________。
(3)四乙基铅[![]() ]曾广泛用作汽油中的抗爆剂,由Pb提供空轨道,有机原子团提供孤电子对形成,该化合物中存在化学键类型有_____________
]曾广泛用作汽油中的抗爆剂,由Pb提供空轨道,有机原子团提供孤电子对形成,该化合物中存在化学键类型有_____________
A.金属键 B.离子键 C.共价键 D.配位键
(4)第三代太阳能电池利用有机金属卤化物碘化铅甲胺(![]() )半导体作为吸光材料,
)半导体作为吸光材料,![]() 具有钙钛矿(
具有钙钛矿(![]() )的立方结构,其晶胞如图所示:
)的立方结构,其晶胞如图所示:
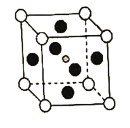
①比较元素电负性:C_________N(填“>”或“<”),比较基态原子第一电离能:C________Pb(填“>”或“<”)
②![]() 晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则M在晶胞中处于_____________位置,X在晶胞中处于________位置。
晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则M在晶胞中处于_____________位置,X在晶胞中处于________位置。
③![]() 晶体的晶胞边长为a nm,其晶体密度为d
晶体的晶胞边长为a nm,其晶体密度为d![]() ,则阿伏加德罗常数的值NA的计算表达式为_____________
,则阿伏加德罗常数的值NA的计算表达式为_____________
【答案】![]()
![]()
![]() 是分子晶体,
是分子晶体,![]() 是离子晶体,
是离子晶体,![]() 是原子晶体
是原子晶体 ![]() 正四面体 CD < > 体心 面心
正四面体 CD < > 体心 面心 ![]()
【解析】
由Pb在周期表的位置写出它的外围电子排布式,根据SiO2、PbO2、CO2晶体类型判断熔沸点高低,根据元素周期律判断电负性及第一电离能的大小,由密度d=![]() ,求出NA即可。
,求出NA即可。
(1)Pb与C元素同族,最外层电子数为4,位于第六周期,则它的外围电子排布式为6s26p2;因为SiO2是原子晶体,熔沸点很高,PbO2是离子晶体,熔沸点较高,CO2是分子晶体,熔沸点较低,所以三种氧化物的熔沸点从小到大分别为CO2<PbO2<SiO2;答案为6s26p2,CO2<PbO2<SiO2;SiO2是原子晶体,PbO2是离子晶体,CO2是分子晶体。
(2)CO32-中心原子没有孤电子对,σ键电子对数为3,中心原子的价层电子对数为3,则轨道的杂化类型是sp2;SO42-中心原子为sp3杂化,则SO42-的空间构型为正四面体;答案为sp2,正四面体。
(3)四乙基铅[(CH3CH2)4Pb]中由Pb提供空轨道,有机原子团提供孤电子对形成配位键,乙基中碳原子和碳原子之间、碳原子和氢原子之间形成共价键;答案为CD。
(4)①C、N属于同周期,同周期从左向右,电负性逐渐增大,则电负性C<N;同一主族元素,元素原子失电子能力随着原子序数的增大而增强,原子失电子能力越强,其第一电离能越小,所以第一电离能大小顺序C>Pb;答案为<,>。
②本题属于立方晶胞,AMX3晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则卤素阴离子必然位于立方体的6个面的面心,正好构成正八面体;M位于八面体的体心,也是立方体的体心;答案为体心,面心。
③晶体体积V=(a×10-7)3cm3,晶体密度d= ![]() g/cm3,则NA=
g/cm3,则NA=![]() =
=![]() ;答案为
;答案为![]() 。
。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学欲除去固体氯化钠中混有的氯化钙,请据如下实验方案回答问题。
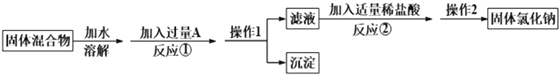
(1)操作1的名称是_____;
(2)反应①中加入略过量的A物质的目的是__________;
(3)写出反应②的化学方程式:_______。
(4)实验时称取样品的质量为185.0g,经过操作1后,测得沉淀(不溶于水)的质量为50.0g, 则样品中NaCl的质量分数是多少___?(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢H2O2,(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2+H2O
C.2H2O2=2H2O+O2
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是(填代号) 。
(2)H2O2既体现氧化性又体现还原性的反应是(填代号) 。
(3)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO![]() +5e-+8H+===Mn2++4H2O
+5e-+8H+===Mn2++4H2O
写出该氧化还原反应的化学方程式:_______________________。
(4)请配平以下化学方程式:
![]() Al+
Al+![]() NaNO3+
NaNO3+![]() NaOH===
NaOH===![]() NaAlO2+
NaAlO2+![]() N2↑+
N2↑+![]() H2O
H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示的转化关系,回答下列问题:
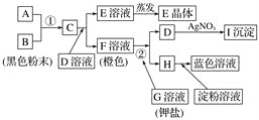
(1)写出反应①的离子方程式:______________________________________________;写出反应②的离子方程式:______________________。
(2)推出下列物质的化学式:E____________;I______________。
(3)在上述转化过程中,B、C、F、H的氧化能力由弱到强的顺序为______________________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中,能使电离平衡H2O![]() H+ + OH-正向移动且溶液呈酸性的是( )
H+ + OH-正向移动且溶液呈酸性的是( )
A. 向水中加入NaHSO4溶液 B. 向水中加入Al2(SO4)3溶液
C. 向水中加入Na2CO3溶液 D. 将水加热到100℃,使水的pH=6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜溶液可用于浸取硫铁矿中的铁,浸取时发生复杂的氧化还原反应,反应体系中除![]() 和
和![]() 外,还有
外,还有![]() 、
、![]() 、
、![]() 和
和![]() ,下列对该反应的分析不正确的是( )
,下列对该反应的分析不正确的是( )
A.氧化剂为![]() 和
和![]()
B.反应后溶液的pH降低
C.每转移2 mol电子消耗3 mol ![]()
D.被氧化的![]() 只占总量的30%
只占总量的30%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象,推出的相应结论正确的是
实验 | 现象 | 结论 |
A.用铂丝蘸取某金属的盐溶液, 在酒精灯火焰上灼烧 | 火焰呈黄色 | 此盐溶液中含有 Na+,不含 K+ |
B.向饱和NaHCO3溶液中加入足量氯水 | 有无色气体产生 | 氯水中含HClO |
C.将足量SO2气体通入石蕊试液中 | 石蕊试液变红色 | SO2水溶液显酸性 |
D.向酸性KMnO4溶液中通入SO2 | 溶液紫色褪去 | SO2具有漂白性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.常温常压下,11.2L氧气所含的原子数为NA
B.标准状况下,1.12L氦气所含的原子数为0.1NA
C.1.8 g NH4+离子中含有的电子数为NA
D.15.6 g Na2O2与过量CO2反应时,转移的电子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸正丁酯是无色透明有果香气味的液体。实验室制备乙酸正丁酯的反应方程式如下:CH3COOH+CH3CH2CH2CH2OH![]() CH3COOCH2CH2CH2CH3+H2O。制备流程和有关数据如下:
CH3COOCH2CH2CH2CH3+H2O。制备流程和有关数据如下:
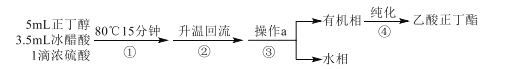
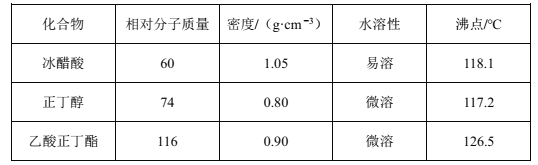
已知:乙酸正丁酯、正丁醇和水组成的三元共沸物的沸点为90.7℃。
反应装置如图所示。在烧瓶中加入反应物和沸石,分水器中加入一定体积水,80℃反应15分钟,然后提高温度使反应处于回流状态,分水器中液面不断上升,当液面达到分水器支管口时,上层液体返回到烧瓶中。

回答下列问题:
(1)仪器甲的名称是___。步骤①在80℃反应时温度计水银球置于___(填“a”或“b”)处。
(2)使用分水器能提高酯的产率,原因是___(用平衡移动原理解释)。
(3)步骤②观察到___(填标号)现象时,酯化反应已基本完成。
A.当分水器中出现分层 B.分水器中有液体回流至烧瓶
C.分水器水层高度不再变化 D.仪器甲有液体滴落
(4)若反应前分水器中加水不足,会导致___,使产率偏低。
(5)步骤③操作a的名称是___。
(6)步骤④中,依次用10%Na2CO3溶液、水洗涤有机相,分出的产物加入少量无水MgSO4固体,蒸馏,得到乙酸正丁酯4.64g。加入10%Na2CO3溶液的目的是除去___。乙酸正丁酯的产率为___%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com