
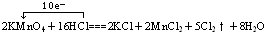 ,故答案为:
,故答案为: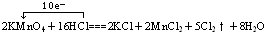 ;
;

科目:高中化学 来源:不详 题型:填空题

 □Cu2++□Fe2++□( )+□SO42-
□Cu2++□Fe2++□( )+□SO42-查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 改变的条件 | 平衡移动的方向 | 平衡移动的过程 |
| 增大反应物的浓度 | ______ | 反应物的浓度______ |
| 减小压强 | ______ | 体系的压强逐渐______ |
| 升高温度 | ______ | 体系的温度逐渐______ |
| 使用合适的催化剂 | ______ | 速率______ 达平衡所需时间______ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该反应从电子转移角度看,与SO2 + 2H2S =" 3S" + 2H2O是同一反应类型 |
| B.该反应从电子转移角度看,每生成6 mol铜,转移电子12 mol |
| C.该反应中,氧元素氧化了硫元素 |
| D.该反应中,Cu2S既是还原剂又是氧化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应中氧化剂是Na2O2,还原剂是FeSO4 |
| B.生成2 mol Na2FeO4时,反应中共有8 mol电子转移 |
| C.Na2FeO4的氧化性大于Na2O2 |
| D.Na2FeO4净水过程中,既有氧化还原反应发生,又有非氧化还原反应发生 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
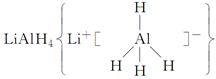 、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈反应放出H2,LiAlH4在125 ℃分解为LiH、H2和Al。下列说法中不正确的是 ( )。
、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈反应放出H2,LiAlH4在125 ℃分解为LiH、H2和Al。下列说法中不正确的是 ( )。| A.LiH与D2O反应,所得氢气的摩尔质量为4 g·mol-1 |
| B.1 mol LiAlH4在125 ℃完全分解,转移3 mol电子 |
| C.LiAlH4溶于适量水得无色溶液,则化学方程式可表示为LiAlH4+2H2O=LiAlO2+4H2↑ |
| D.LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com