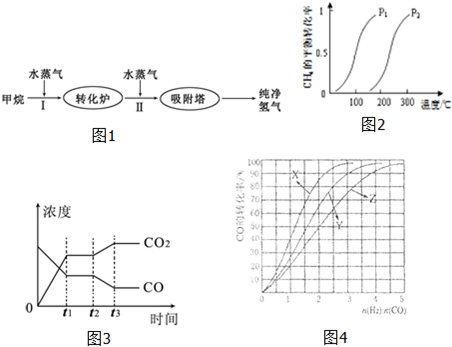
��������1����ȡ���Ʊ�������������ͼ��֪�¶���ͬʱ������ƽ��ʱ��ѹǿΪP
1��CH
4ת���ʸߣ���ӦΪ�����������ķ�Ӧ������ѹǿƽ���������С�ķ����ƶ������ݻ�ѧƽ������ʽ��ʽ����ƽ��Ũ�Ƚ��ƽ�ⳣ���������õ���
��2������ͼ�����ݿ�֪ƽ�ⳣ�����¶�����С��˵��ƽ��������У�����Ӧ�Ƿ��ȷ�Ӧ�����ƽ������ʽ����ת����=
��100%����t
2ʱ����ı�ij������Ũ�ȷ����仯������Ƕ�����̼Ũ������һ����̼Ũ�ȼ�С�����ƽ���ƶ�ԭ��������
��3������CO��CH
3OH��ȼ��������д�ȷ���ʽ�������ø�˹�����������״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��
��4�����ݷ�Ӧ�Ƿ��ȷ�Ӧ���¶�Խ�ߣ���Ӧ��ת����ԽС��COΪ�ж����巴Ӧʱ��������ȫת����ͼ������жϷ�Ӧ�¶���Ͷ�ϱȵĹ�ϵ��
��5������ͼ�������Ͷ�ϱ�Ϊ1��1��һ����̼ת����Ϊ40%�����ݻ�ѧƽ������ʽ���㣮
���
�⣺��1����ͼ��֪�¶���ͬʱ������ƽ��ʱ��ѹǿΪP
1��CH
4ת���ʸߣ�ƽ��������Ӧ�����ƶ�����ӦΪ�����������ķ�Ӧ������ѹǿƽ���������С�ķ����ƶ�����P
1��P
2��100��ʱ����1mol CH
4��2mol H
2Oͨ���ݻ�Ϊ100L�ĺ����ܱ������У��ﵽƽ��ʱCH
4��ת����Ϊ0.5��
CH
4��g��+H
2O��g��?CO��g��+3H
2��g��
��ʼ����mol/L�� 0.01 0.02 0 0
�仯����mol/L�� 0.005 0.005 0.005 0.015
ƽ������mol/L�� 0.005 0.015 0.005 0.015
ƽ�ⳣ��K=
=
| 0.005��0.0153 |
| 0.005��0.015 |
=2.25��10
-4��mol/L��
2��
�ʴ�Ϊ������2.25��10
-4��
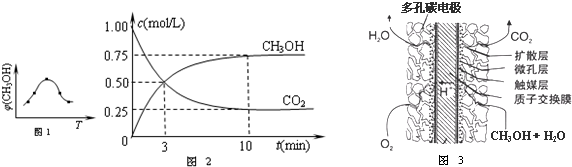
��2������ͼ�����ݿ�֪ƽ�ⳣ�����¶�����С��˵��ƽ��������У�����Ӧ�Ƿ��ȷ�Ӧ����H��0������500��ʱ���У�����ʼʱCO��H
2O����ʼŨ�Ⱦ�Ϊ0.020mol/L��ƽ�ⳣ��Ϊ9�����ݻ�ѧƽ������ʽ��ʽ���㣬��һ����̼�������ʵ���Ũ��Ϊx������ƽ�ⳣ���õ���
CO��g��+H
2O��g��?H
2��g��+CO
2��g����
��ʼ����mol�� 0.02 0.02 0 0
�仯����mol�� x x x x
ƽ������mmol��0.02-x 0.02-x x x
K=
=9
x=0.015mol/L
CO��ת����=
��100%=75%
CO��g��+H
2O��g��?H
2��g��+CO
2��g������Ӧ�������������ķ��ȷ�Ӧ����t
2ʱ����ı�ij������Ũ�ȷ����仯������Ƕ�����̼Ũ������һ����̼Ũ�ȼ�С��˵��ƽ��������У������¶ȣ�������ˮ���������������������������ʵ�֣�
�ʴ�Ϊ�����ȣ�75%�������¶ȣ�������ˮ�������������������������
��3������CO��g����CH
3OH��l����ȼ���ȡ�H�ֱ�Ϊ-283.0kJ?mol
-1��-726.5kJ?mol
-1����
��CO��g��+
O
2��g��=CO
2��g����H=-283.0kJ?mol
-1 ��CH
3OH��l��+
O
2��g��=CO
2��g��+2 H
2O��l����H=-726.5kJ?mol
-1 �ɸ�˹���ɿ�֪����-�ٵ÷�ӦCH
3OH��l��+O
2��g��=CO��g��+2 H
2O��l�������H=-726.5kJ?mol
-1-��-283.0kJ?mol
-1��=-443.5kJ?mol
-1��
�ʴ�Ϊ��CH
3OH��l��+O
2��g��=CO��g��+2H
2O��l����H=-443.5kJ?mol
-1��
�ڹ�ҵ���÷�Ӧ�ܵ�ѹ�ϳɼ״�����230�桫270����Ϊ������Ϊ�о��ϳ�������ʵ���ʼ��ɱȣ��ֱ���230�桢250���270�����ʵ�飬�����ͼ���ϳɼ״��Ƿ��ȷ�Ӧ���¶�Խ��ת����Խ���ͼ���֪��270���ʵ��������Ӧ��������Z��COΪ�ж����巴Ӧʱ��������ȫת������ͼ�����Ͷ�ϱ�Խ�ߣ���Ӧ�ķ�Ӧ�¶�Խ�ߣ�
�ʴ�Ϊ��Z��Ͷ�ϱ�Խ�ߣ���Ӧ�ķ�Ӧ�¶�Խ�ߣ�
�۵�Ͷ�ϱ�Ϊ1��1���¶�Ϊ230�棬����Ϊx��ͼ������жϣ�һ����̼ת����Ϊ40%��
CO��g��+2H
2��g��?CH
3OH��g��
��ʼ����mol�� x x 0
�仯����mol�� 0.4x 0.8x 0.4x
ƽ������mol��0.6x 0.2x 0.4x
��ƽ���������У�CH
3OH�����ʵ�������=
��100%=33.3%��
�ʴ�Ϊ��33.3%��





 ��ƽ����ϵA+B�TC+D������ѹǿʱ��Ӧ���ʱ仯��ͼ��ʾ�������й��ڸ�����״̬��˵����ȷ���ǣ�������
��ƽ����ϵA+B�TC+D������ѹǿʱ��Ӧ���ʱ仯��ͼ��ʾ�������й��ڸ�����״̬��˵����ȷ���ǣ������� �ɱ�ʾΪ
�ɱ�ʾΪ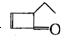 ��ij�л���
��ij�л��� �Ķ���ͬ���칹���У����ڷ��㴼��һ���У������������칹����������
�Ķ���ͬ���칹���У����ڷ��㴼��һ���У������������칹����������