

 ,
, ,
, .
. 分析 (1)含苯环的烃称为芳香烃;
(2)结构相似,在分子组成上相差一个或若干个CH2原子团的化合物互为同系物;
(3)分子式相同而结构不同的化合物互为同分异构体,据此分析.
解答 解:(1)含苯环的烃称为芳香烃,故它们的共同类别是芳香烃,故答案为:芳香烃;含苯环的烃;
(2)结构相似,在分子组成上相差一个或若干个CH2原子团的化合物互为同系物,互为同系物的物质有相同的通式,而①②③中均只含一个苯环,故结构相似,且分子组成上相差一个或若干个CH2原子团,且通式相同,故互为同系物;通式为CnH2n-6,故答案为:①②③;CnH2n-6;
(3)分子式相同而结构不同的化合物互为同分异构体,③为邻二甲苯,和间二甲苯、对二甲苯和乙苯互为同分异构体,结构简式分别为 ,
, ,
, ,故答案为:
,故答案为: ,
, ,
, .
.
点评 本题考查了苯的同系物、芳香烃的有关判断,应注意的是互为同系物的物质的结构必须相似,且必须通式相同.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:实验题
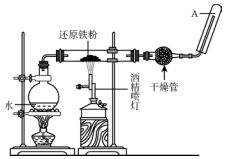 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应,应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验”.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应,应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验”.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6 L CCl4中含有的分子数目为0.25NA | |
| B. | 标准状况下,体积为22.4L的物质所含微粒数是NA | |
| C. | 常温常压下,0.5 mol NH3中含有的原子数目为2NA | |
| D. | 500mL1 mol•L-1 K2SO4溶液中含有的k+数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | H2(g) | CO(g) | CH3OH(l) |
| 标准燃烧热(25℃) △H/kJ•mol-1 | -285.8 | -283.0 | -726.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲、乙、丙、丁是四中含有同一元素的物质,其中甲是单质,丁是其最高化合物对应的水化物,它们之间有如图所示的转化关系,则丁不可能是( )
甲、乙、丙、丁是四中含有同一元素的物质,其中甲是单质,丁是其最高化合物对应的水化物,它们之间有如图所示的转化关系,则丁不可能是( )| A. | NaOH | B. | H2SiO3 | C. | HNO2 | D. | H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com