
| A、pH=l的溶液中:Ca2+、Fe2+,NO3- |
| B、c(OH-)=10-2的溶液中:Na+、AlO2-、Cl- |
| C、c(Fe3+)=0.1 mol?L-1的溶液中:K+、SCN-、SO42- |
| D、由水电离的c(H+)=1×10-14 mol?L-1的溶液中;Na+、AlO2-、CO32- |


科目:高中化学 来源: 题型:
| A、风力发电 | B、汽车尾气 |
| C、煤炭燃烧 | D、建筑扬尘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作及现象 | 实验结论 | |
| A | 分别向2mL 0.1mol?L-1 CH3COOH溶液和2mL 0.1mol?L-1 H3BO3溶液中滴加等浓度的NaHCO3溶液,前者有气泡产生,后者无明显现象 | 酸性: CH3COOH>H2CO3>H3BO3 |
| B | 向2mL 0.1mol?L-1 NaOH溶液中滴加3滴0.1mol?L-1 MgCl2溶液,出现白色沉淀后,再滴加3滴0.1mol?L-1 FeCl3溶液,出现红褐色沉淀 | 溶解度: Mg(OH)2>Fe(OH)3 |
| C | 在少量无水乙醇中加入金属Na,生成可以在空气中燃烧的气体 | CH3CH2OH是弱电解质 |
| D | 用3mL稀H2SO4溶液与足量Zn反应,当气泡稀少时,加入 1mL浓H2SO4,又迅速产生较多气泡 | H2SO4浓度增大,反应速率加快 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、装置①可用于已知浓度的氢氧化钠溶液测定未知浓度盐酸的实验 |
| B、装置②可用于氯化铵固体和氢氧化钙固体反应制取少量氨气 |
| C、装置③可用于收集SO2,并吸收多余的SO2 |
| D、装置④可用于制取少量Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
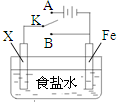
| A、若X为锌棒,开关K置于A处,可减缓铁的腐蚀,这种方法称为牺牲阴极的阳极保护法 | ||||
B、若X为铜棒,开关K置于A处,装置中发生的总反应为2NaCl+2H2O
| ||||
| C、若X为碳棒,开关K置于B处,在铁棒附近滴入硫氰化钾溶液可看到溶液变血红色 | ||||
| D、若X为碳棒,开关K置于B处,向食盐水中滴入酚酞溶液可看到碳棒附近先变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| v(N2) |
| v(O2) |
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.(固定装置略去)
某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.(固定装置略去)| 方案 | 反应物 |
| 甲 | Cu、浓HNO3 |
| 乙 | Cu、稀HNO3 |
| 丙 | Cu、Zn、稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石灰石与盐酸反应:CO32-+2H+═CO2↑+H2O |
| B、Cl2通入烧碱溶液中:Cl2+2OH-═Cl-+ClO-+H2O |
| C、氢氧化铜和硫酸反应:OH-+H+═H2O |
| D、将金属铝(无氧化膜)加入氢氧化钠溶液中:Al+2OH-═AlO2-+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com