
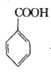
【题目】苯甲酰氯(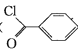 )是制备染料,香料药品和树脂的重要中间体,以光气法制备苯甲酰氯的原理如下(该反应为放热反应):
)是制备染料,香料药品和树脂的重要中间体,以光气法制备苯甲酰氯的原理如下(该反应为放热反应):
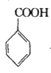 +COCl2
+COCl2![]()
![]() +CO2+HCl
+CO2+HCl
已知物质性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 溶解性 |
苯甲酸 | 122.1 | 249 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 |
碳酰氯(COCl2) | -188 | 8.2 | 较易溶于苯、甲苯等。遇水迅速水解,生成氯化氢,与氨很快反应,主要生成尿素[CO(NH2)2]和氯化铵等无毒物质 |
苯甲酰氯 | -1 | 197 | 溶于乙醚、氯仿和苯。遇水或乙醇逐渐分解,生成苯甲酸或苯甲酸乙酯和氯化氢 |
三氯甲烷(CHCl3) | -63.5 | 63.1 | 不溶于水,溶于醇、苯。极易挥发,稳定性差,450℃以上发生热分解 |
I.制备碳酰氯
反应原理:2 CHCl3+O2![]() 2HCl+COCl2
2HCl+COCl2
甲. 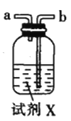 乙.
乙. 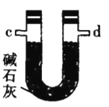 丙.
丙. 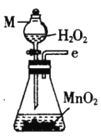 丁.
丁. 戊
戊 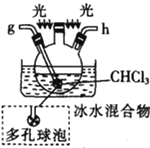
(1)仪器M的名称是____________
(2)按气流由左至右的顺序为___________→c→d→_________→_________→_________→_________→_________.
(3)试剂X是_______________(填名称)。
(4)装置乙中碱石灰的作用是____________。
(5)装置戊中冰水混合物的作用是____________;多孔球泡的作用是________________。
Ⅱ.制备苯甲酰氯(部分夹持装置省略)
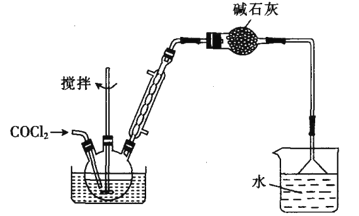
(6)碳酰氯也可以用浓氨水吸收,写出该反应的化学方程式:______________。
若向三颈烧瓶中加入610g苯甲酸,先加热至140~150℃,再通入COCl2,充分反应后,最后产品经减压蒸馏得到562g苯甲酰氯,则苯甲酸的转化率为_________________。
【答案】分液漏斗 e g h b a f 浓硫酸 干燥气体,防止水蒸气进入装置戊中 防止三氯甲烷挥发,使碳酰氯液化 增大反应物之间的接触面积,加快反应速率 COCl2+4NH3H2O = CO(NH2)2+2NH4Cl+4H2O 79.3%
【解析】
(1)看图得出仪器M的名称。
(2)根据已知,碳酰氯与水反应,因此要干燥氧气,且后面产物中要隔绝水蒸气,再得出顺序。
(3)根据已知信息,碳酰氯不能见水,因此整个环境要干燥,故得到答案。
(4)根据(2)中得到装置乙中碱石灰的作用是干燥气体。
(5)根据碳酰氯(COCl2)沸点低,三氯甲烷易挥发,得出结论,多孔球泡的作用是增大反应物之间的接触面积,加快反应速率。
Ⅱ(6)碳酰氯也可以用浓氨水吸收,生成尿素和氯化铵,再写出反应方程式,先根据方程式计算实际消耗了苯甲酸的质量,再计算转化率。
(1)仪器M的名称是分液漏斗,故答案为:分液漏斗。
(2)根据已知,碳酰氯与水反应,因此要干燥氧气,且后面产物中要隔绝水蒸气,因此X要用浓硫酸干燥,按气流由左至右的顺序为e→c→d→g→h→b→a→f,故答案为:e;g;h;b;a;f。
(3)根据上题得出试剂X是浓硫酸,故答案为:浓硫酸。
(4)根据(2)中得到装置乙中碱石灰的作用是干燥气体,防止水蒸气进入装置戊中,故答案为:干燥气体,防止水蒸气进入装置戊中。
(5) 碳酰氯(COCl2)沸点低,三氯甲烷易挥发,因此装置戊中冰水混合物的作用是防止三氯甲烷挥发,使碳酰氯液化;多孔球泡的作用是增大反应物之间的接触面积,加快反应速率,故答案为:防止三氯甲烷挥发,使碳酰氯液化;增大反应物之间的接触面积,加快反应速率。
Ⅱ(6)碳酰氯也可以用浓氨水吸收,生成尿素和氯化铵,该反应的化学方程式:COCl2+4NH3H2O = CO(NH2)2+2NH4Cl+4H2O,
 +COCl2
+COCl2![]()
![]() +CO2+HCl
+CO2+HCl
121g 140.5g
xg 562g
121g:xg = 140.5g:562g
解得x=484g
![]() ,故答案为:COCl2+4NH3H2O = CO(NH2)2+2NH4Cl+4H2O,79.3%。
,故答案为:COCl2+4NH3H2O = CO(NH2)2+2NH4Cl+4H2O,79.3%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为___。
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中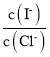 为:___,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
为:___,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)Bodensteins研究了下列反应:2HI(g)H2(g)+I2(g) ΔH=+11kJ·mol-1,
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
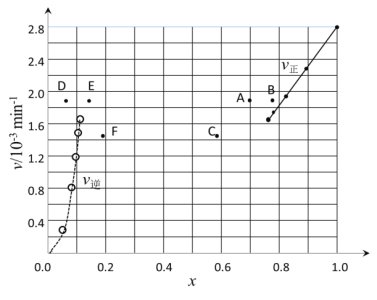
①根据上述实验结果,该反应的平衡常数K的计算式为___。若起始时n(HI)=100mol,则过程中需吸收的能量为___kJ。
②上述反应中,正反应速率为v正=k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为___(以K和k正表示)。
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为___(填字母)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】80℃时,NO2(g)+SO2(g)![]() SO3(g)+NO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列判断不正确的是( )
SO3(g)+NO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列判断不正确的是( )
起始浓度 | 甲 | 乙 | 丙 |
c(NO2)/mol ·L-1 | 0.10 | 0.20 | 0.20 |
c(SO2)/mol ·L-1 | 0.10 | 0.10 | 0.20 |
A.平衡时,乙中SO2的转化率大于50%
B.当反应平衡时,丙中c(SO2)是甲中的2倍
C.温度升至90℃,上述反应平衡常数为25/16,则正反应为吸热反应
D.其他条件不变,若起始时向容器乙中充入0.10mol ·L-1 NO2和0.20 mol ·L-1 SO2,达到平衡时c(NO)与原平衡不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种化合物,均含有某种常见元素,它们的转化关系如下图所示,其中A为澄清溶液,C为难溶于水的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。请回答下列问题:

(1)写出化学式:A__________C__________
(2)写出下列反应的离子方程式:
A→B:________________________________。
B→D:________________________________。
C→E:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气与适量氯气混合反应可生成NH4Cl(俗称脑砂)和一种无污染的气体。某学习小组利用下列装置模拟该反应,请回答相关问题。

(1)该实验中所需的氯气是用浓盐酸与MnO2反应制取。装置A中仪器X的名称为____;X中发生反应的离子方程式为_______。
(2)要得到干燥纯净的氯气,上述A、B、C装置的连接顺序依次为a→_____(用小写字母表示)。
(3)利用E装置,将适量氨气与氯气充分混合反应氨气应从_______(用小写字母表示)通入,反应的化学方程式为_______________;可能观察到的现象是___________。
(4)《唐本草》记载脑砂入药可以散瘀消肿,天然脑砂含少量NH4Cl,现取天然脑砂进行NH4Cl含量测定。准确称取一定质量脑砂,与足量的氧化铜混合,如下图所示进行实验。已知:2NH4Cl+3CuO=3Cu+N2+2HCl+3H2O 。
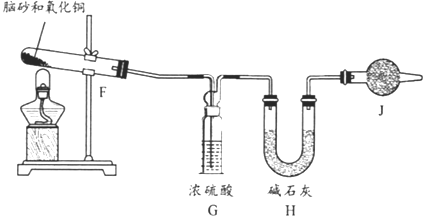
①为顺利完成有关物理量的测定,请完善下列表格:
测量时间点 | 加热前 | 当观察到_____现象时 |
测量内容 | _______________ | 停止加热,冷却,称量H装置的总质量 |
②如果不用J装置,测出NH4Cl的含量将_____(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 4NH3+5O2 = 4NO+6H2O(g),若反应速率分别用 v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是( )
A.v(O2)=![]() v(NH3)B.v(H2O)=
v(NH3)B.v(H2O)= ![]() v(O2)C.v(H2O)=
v(O2)C.v(H2O)=![]() v(NH3)D.v(NO)=
v(NH3)D.v(NO)= ![]() v(O2)
v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读下列材料后,回答相应问题。
铁在人体中以Fe2+和Fe3+的形式存在。二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的铁盐,如硫酸亚铁(FeSO4)。
(1)人体中经常进行转化Fe2+![]() Fe3+,A反应中Fe2+作__剂,B反应中Fe3+作__剂,服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利于铁的吸收。这说明维生素C具有__性。
Fe3+,A反应中Fe2+作__剂,B反应中Fe3+作__剂,服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利于铁的吸收。这说明维生素C具有__性。
(2)新配制的FeCl2溶液应加入__以防止FeCl2转化为FeCl3,要除去FeCl3溶液中少量的FeCl2杂质,可向其中通入适量的__。
(3)为除去废水中的Fe2+,常先将废水中的Fe2+氧化为__(用离子符号表示),再__使Fe3+转化为红褐色的__(用化学式表示)沉淀析出。
(4)在制作印刷电路板的过程中常利用铜与氯化铁溶液的反应。反应的离子方程式为__。
(5)为消除废气中的Cl2对环境的污染,将废气通过含有铁粉的FeCl2溶液,即可有效地除去Cl2,这一处理过程可用两个离子方程式表示为__,__;处理过程中需定期添加的原料是__。
(6)某同学为检验某未知溶液中是否为FeCl2溶液,采取如下实验方案加以验证:取少许未知试液于试管中![]()
![]() 溶液呈红色(证明含有FeCl2),你认为此方案__(填“合理”或“不合理”),若不合理,如何改进:__。
溶液呈红色(证明含有FeCl2),你认为此方案__(填“合理”或“不合理”),若不合理,如何改进:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是合成抗炎药洛索洛芬钠的关键中间体,它的一种合成路线如下:
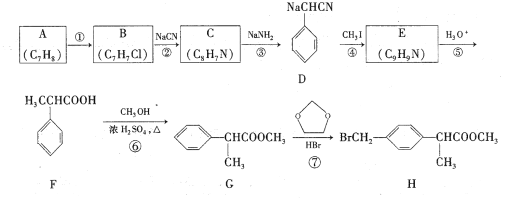
回答下列问题:
(1)A的名称是____,H中官能团名称是____;
(2)反应①的反应条件为____;
(3)反应⑥的化学方程式为________;反应类型为____。
(4)反应⑦除生成H外,还生成了另一种有机产物的结构简式为____。
(5)符合下列条件的G的同分异构体有____种。
I.能发生银镜反应 Ⅱ.苯环上一氯取代物只有一种 Ⅲ.核磁共振氢谱有4组峰
(6)仿照H的合成路线,设计一种由B合成![]() 的合成路线___。
的合成路线___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com