

| A. | 凯库勒 | B. | 道尔顿 | C. | 拉瓦锡 | D. | 门捷列夫 |
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和时所需KOH 的量 | B. | CH3COOH电离程度 | ||
| C. | H+的物质的量浓度 | D. | CH3COOH的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
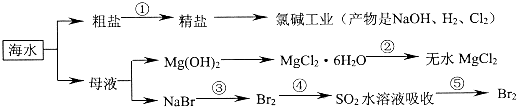
| A. | 以NaCl为工业原料可以生产烧碱、纯碱以及漂白粉等含氯产品 | |
| B. | 工业上通过电解饱和MgCl2溶液制取金属镁 | |
| C. | 第③④⑤步的目的是浓缩、富集溴单质,这三步中溴元素均被氧化 | |
| D. | 过程①除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2和O3互为同素异形体 | |
| B. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H和${\;}_{1}^{3}$H互为同位素 | |
| C. | CH2═CH2和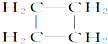 互为同系物 互为同系物 | |
| D. | 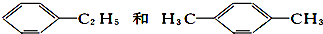 互为同分异构体 互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m=4,n=2 | B. | m=4,n=5 | C. | m=3,n=3 | D. | m=5,n=3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol•L-1 的KCl溶液 | B. | 0.1L 0.2mol•L-1的盐酸溶液 | ||
| C. | 0.1L 0.1 mol•L-1的MgCl2溶液 | D. | 0.1L 0.1mol•L-1的AlCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com