
【题目】从粗铜精炼的阳极泥(主要含有Cu2Te)中提取粗碲的一种工艺流程如图:(已知TeO2微溶于水,易溶于强酸和强碱) 下列有关说法正确的是

A. “氧化浸出”时为使碲元素沉淀充分,应加入过量的硫酸
B. “过滤”用到的玻璃仪器:分液漏斗、烧杯、玻璃棒
C. “还原”时发生的离子方程式为2SO32-+Te4++4OH-=Te↓+2SO42-+2H2O
D. 判断粗碲洗净的方法:取少量最后一次洗涤液,加入BaCl2溶液,没有白色沉淀生成
【答案】D
【解析】
A.由题中信息可知,TeO2微溶于水,易溶于强酸和强碱,是两性氧化物。Cu2Te与硫酸、氧气反应,生成硫酸铜和TeO2,硫酸若过量,会导致TeO2的溶解,造成原料的利用率降低,故A错误;
B.“过滤”用到的玻璃仪器:漏斗、烧杯、玻璃棒,故B错误;
C.Na2SO3加入到Te(SO4)2溶液中进行还原得到固态碲,同时生成Na2SO4,该反应的离子方程式是2SO32-+Te4 ++2H2O=Te↓+2SO42-+4H+,故C错误;
D.通过过滤从反应后的混合物中获得粗碲,粗碲表面附着液中含有SO42-,取少量最后一次洗涤液,加入BaCl2溶液,若没有白色沉淀生成,则说明洗涤干净,故D正确。
故选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】甲基丙烯酸甲酯是合成有机玻璃的单体,其合成方法之一如下:CH3OC≡CH+CH3OH+A![]() CH2=C(CH3)COOCH3,下列说法正确的是( )
CH2=C(CH3)COOCH3,下列说法正确的是( )
A.已知该反应的原子利用率为100%,则A为CO2
B.CH3OH和甘油互为同系物
C.CH3C≡CH与丙烯的性质相似,则该物质可以发生加成、氧化反应
D.能与NaHCO3反应的CH2=C(CH3)COOCH3的同分异构体有9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物结构和性质的说法正确的是( )
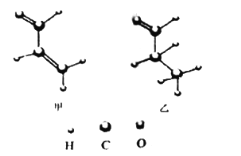
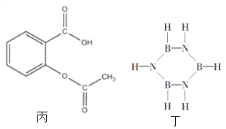
A. 甲中所有原子可能处于同一平面
B. 乙的一氯代物有4种
C. 丙一定条件下能发生的反应类型有取代,加成,氧化,消去反应
D. 丁与苯互为等电子体,可由苯的结构和性质推测丁的结构与性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2是一种重要的清洁能源。
(1)2018年我国某科研团队利用透氧膜,一步即获得合成氨原料和合成液态燃料的原料。其工作原理如图所示(空气中N2与O2的物质的量之比按4:1计)。工作过程中,膜I侧所得![]() =3,则膜I侧的电极方程式为________________________。
=3,则膜I侧的电极方程式为________________________。

(2)已知: CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2=-49.0kJ/mol,
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3= -41.1 kJ/mol,H2还原CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g)ΔH1,则ΔH1=_____________ kJ/mol,该反应自发进行的条件为_________。
CH3OH(g)ΔH1,则ΔH1=_____________ kJ/mol,该反应自发进行的条件为_________。
A.高温 B.低温 C.任何温度条件下
(3)恒温恒压下,在容积可变的密闭容器中加入1mol CO和2.2 mol H2,发生反应 CO(g)+2H2(g)![]() CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。
CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。

P1_______P2,判断的理由是____________________________。
(4)若反应CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1L的密闭容器中发生,反应过程中各物质的物质的量随时间变化见下表所示:
CH3OH(g)在温度不变且体积恒定为1L的密闭容器中发生,反应过程中各物质的物质的量随时间变化见下表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
①下列各项能作为判断该反应达到平衡标志的是_____(填字母);
A.容器内压强保持不变 B.2v正(H2)=v逆(CH3OH)
C.混合气体的相对分子质量保持不变 D.混合气体的密度保持不变
②若起始压强为P0 kPa,则在该温度下反应的平衡常数Kp=__________(kPa)-2。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)= _______Pa/min。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除尾气中的NO是环境科学研究的热点课题。
I.NO氧化机理
已知:2NO(g)+O2(g)===2NO2(g)△H=-110kJ·mol-1;25℃时,将NO和O2按物质的量之比为2:1充入刚性反应容器中,用测压法研究其反应的进行情况。体系的总压强p随时间t的变化如下表所示(忽略NO2与N2O4的转化)
t/min | 0 | 80 | 160 |
|
p/kpa | 75.0 | 63.0 | 55.0 | 55.0 |
(1)0~80min,v(O2)=_____kPa/min;随着反应进行,反应速率逐渐减小的原因是____。用压强代替浓度所得到的平衡常数用K(p)表示,25℃时,K(p)的值为____(保留3位有效数字)。
(2)查阅资料,对于总反应2NOg)+O2(g)=2NO2(g)有如下两步历程
第一步2NO(g)====N2O2(g) 快速反应
第二步N2O2(g)+O2(g)=2NO2(g) 慢反应
总反应速率主要由第______步决定;若利用分子捕获器适当减少反应容器中的N2O2,总反应的平衡常数K(p)将___(填“增大”、“减小”或“不变”);若提高反应温度至35℃,则体系压强p∞(35℃)______p∞(25℃)(填“大于”、“等于”或“小于”)。
II.NO的工业处理
(3)H2还原法:2NO(g)+2H2(g)===N2(g)+2H2O(g);△H=a;已知在标准状况,由元素最稳定的单质生成1mol纯化合物时的焓变叫标准摩尔生成焓。NO(g)和H2O(g)的标准摩尔生成焓分别为+90kJ/mol、-280kJ/mol,则a=_____。
(4)O3-CaSO3联合处理法
NO可以先经O3氧化,再用CaSO3水悬浮液吸收生成的NO2,转化为HNO2,则悬浮液吸收NO2的化学方程式为__________;CaSO3水悬浮液中加入Na2SO4溶液能提高SO32-对NO2的吸收速率。请用平衡移动原理解释其主要原因_________________(结合化学用语和文字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业电解饱和食盐水模拟装置的结构如图所示:


(1)写出电解饱和食盐水的化学方程式____,该工业称___工业。
(2)实际生产中使用的盐往往含有一些杂质,在电解食盐水之前,需要提纯食盐水。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作,①过滤 ②加过量的NaOH溶液 ③加适量的盐酸 ④加过量的Na2CO3溶液 ⑤加过量的BaCl2溶液,操作正确的顺序是____(选填字母)
a.①④②⑤③ b.⑤②④①③ c.②⑤④①③ d.⑤②④③①
(3)在该装置中写出装NaOH溶液试管中所发生的化学反应方程式_____。
(4)工业上用____(写物质名称)和电解产物____反应可制得漂粉精, 漂粉精敞口放置于空气中易失效,原因是(用化学方程式表示)___、____。
(5)工业上用两种电解产物在如图合成塔中合成氯化氢,A处通入___,B处通入___,后将氯化氢溶于水中即可得到盐酸,其电离方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】36.5gHCl溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为w,物质的量浓度为cmol/L,NA表示阿伏加德罗常数的值,则下列叙述中正确的是( )
A. 所得溶液的物质的量浓度:c=1mol/LB. 所得溶液中含有NA个HCl分子
C. 36.5gHCl气体占有的体积为22.4LD. 所得溶液的质量分数w=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用1.0mol/L的NaOH溶液中和某浓度的H2SO4溶液,其水溶液的pH和所用NaOH溶液的体积变化关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )
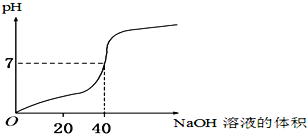
A.1.0 mol/L,20 mL B.0.5 mol/L,40 mL
C.0.5 mol/L,80 mL D.1.0 mol/L,80 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com