
【题目】可证明次氯酸是弱酸的实验事实是( )
A. 次氯酸可与强碱反应
B. 次氯酸钙可与碳酸反应生成次氯酸
C. 次氯酸有漂白性
D. 次氯酸见光分解
科目:高中化学 来源: 题型:
【题目】测得某溶液中仅含Cu2+、K+、SO42-、Cl-四种离子,且阳离子的数量比为Cu2+:K+=3:4,则SO42-:Cl-的比值可能是
A. 3:2 B. 2:1 C. 1:8 D. 任意比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)![]() 2C(g)达到平衡时,各物质的物质的量之比是n(A)∶n(B) ∶n(C)=2∶2∶l。保持温度不变,以2∶2∶1的物质的量之比再充入A,B,C,则( )
2C(g)达到平衡时,各物质的物质的量之比是n(A)∶n(B) ∶n(C)=2∶2∶l。保持温度不变,以2∶2∶1的物质的量之比再充入A,B,C,则( )
A. 平衡向正方向移动 B. 平衡不发生移动
C. C的体积分数减小 D. C的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL 0.2mol/L H2A溶液中滴加0.2 mol/L NaOH溶液,含A元素的有关微粒物质的量变化如下图所示。根据图示判断,下列说法正确的是
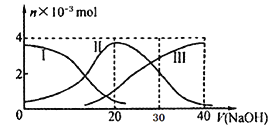
A. H2A在水中的电离方程式是:H2A== H++HA-;HA-![]() H++A2-
H++A2-
B. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
C. 当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+ c(HA-)+ 2c(H2A)=c(A2-)+2c(OH-)
D. 当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某碱性蓄电池在充电和放电时发生的反应为:
Fe+NiO2+2H2O![]() Fe(OH)2+Ni(OH)2,下列说法中正确的是
Fe(OH)2+Ni(OH)2,下列说法中正确的是
A. 放电时,负极上发生反应的物质是Fe
B. 放电时,正极反应是:NiO2+2e-+2H+=Ni(OH)2
C. 充电时,阴极反应是:Ni(OH)2-2e-+2OH-=NiO2+2H2O
D. 充电时,阳极附近pH值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
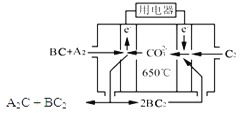
【题目】短周期主族元素A、B、C、D、E原子序数依次增大 ,A是元素周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C原子的最外层电子数是次外层电子数的3倍,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物W分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为_______。W的电子式_________。
(2)在某温度下容积均为2 L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)![]() X(g) H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g) H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2 mol A2、1 mol BC | 1 mol X | 4 mol A2、2 mol BC |
平衡时n(X) | 0.5 mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | P1 | P2 | P3 |
反应物的转化率 |
|
|
|
① 计算该温度下此反应的平衡常数K =_________________。
②三个容器中的反应分别达平衡时下列各组数据关系正确的是___________(填字母)。
A.α1+α2=1 B.Q1+Q2=Q C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0 mol F.Q3=2Q1
(3)熔融碳酸盐燃料电池(MCFC)是一种高温燃料电池,被称为第二代燃料电池,是未来民用发电的理想选择方案之一,其工作原理如图所示。现以A2(g)、BC(g)为燃料,以一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出该碳酸盐燃料电池(MCFC)正极的电极反应式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料。下列说法一定正确的是( )
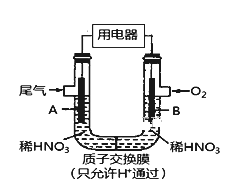
A. 该电池工作时,电子的流向外电路由A到B,内电路由B到A形成闭合回路
B. 电极B附近的HNO3浓度增大
C. A电极的反应为:NO2-e-+H2O==NO3-+2H+ NO-3e-+2H2O===NO3-+4H+
D. 该电池工作时,每消耗11.2LO2(标准状况下),可以除去含1molNO和NO2的混合尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要的化工产品,有广泛用途,工业上可以由氢气和氮气合成。
(1)已知键能:N![]() N 945kJ·mol-1,H-H 436 kJ·mol-1,N-H 391kJ·mol-1。
N 945kJ·mol-1,H-H 436 kJ·mol-1,N-H 391kJ·mol-1。
①氮气、氢气合成氨的热化学方程式是______________。
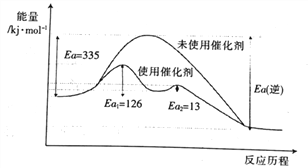
②未使用催化剂时,逆反应的活化能Ea(逆)=______ kJ·mol-1;使用催化剂之后正反应的总活化能为_______ kJ·mol-1。
(2)下表是当反应器中按n(N2):n(H2)=l:3投料后,在200℃、400℃、600℃,反应达到平衡时,混合物中NH3的物质的量分数随总压强的变化曲线。
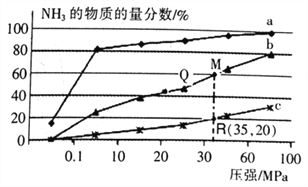
①曲线a、b对应温度较高的是________ (填“a”或“b”)
②实验室模拟工业合成氨,一定温度和压强下在1L密闭容器中通入5 mol N2、15molH2,10min 后达到M点平衡状态,计算从反应开始至平衡时间段内的平均速率V(N2)___mol·L-1·min-1。
③关于工业合成氨的反应,下列叙述正确的是_______(填字母)。
A.分离出NH3后的原料气循环利用,可以提高H2的平衡转化率
B.使州催化剂能加快反应速率且提高H2的平衡转化率
C.上图中M、Q、R点平衡常数K的大小关系是K(M)= K(Q)> K(R)
④列出R点平衡常数的计算式Kp=____(MPa)-2。(用平衡分压代替平衡浓度计箅,分压=总压×物质的量分数。不要求计算结果)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com