
| A、XeO4 |
| B、BeCl2 |
| C、CH4 |
| D、PCl3 |
科目:高中化学 来源: 题型:
| A、过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑ |
| B、钠放入水中:2Na+2H2O=2Na++2OH-+H2↑ |
| C、碳酸氢钙溶液中加入足量烧碱溶液:HCO3-+OH-=CO32-+H2O |
| D、AlCl3溶液中滴加浓氨水至过量:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、小于100mL |
| B、等于100mL |
| C、大于100mL |
| D、等于100/ρ mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、保持容器容积和温度不变,向容器内补充了NO2 |
| B、保持容器压强和温度不变,向容器内补充了N2O4 |
| C、保持容器容积和温度不变,向容器内补充了N2 |
| D、保持容器的容积不变,升高了温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑤⑦ | B、②③⑥⑧ |
| C、②④⑥⑦ | D、只有③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
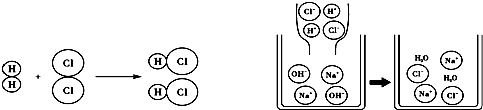
| A、该图可说明所有物质都是由分子构成的 |
| B、以上图示中未涉及置换反应 |
| C、两幅图表示的都是化合反应 |
| D、原子在化学变化中是可以再分的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol甲醇中含有C-H键的数目为4NA |
| B、25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| C、常温下,18g重水(D2O)所含的电子数为10NA |
| D、一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com