
【题目】在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)![]() CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是
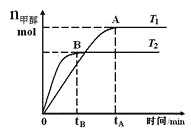
A. 平衡常数K=![]()
B. 该反应在T1时的平衡常数比T2时的小
C. CO合成甲醇的反应为吸热反应
D. 处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
科目:高中化学 来源: 题型:
【题目】在T℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知T℃时AgCl的Ksp=2×10 -10,下列说法不正确的是( )
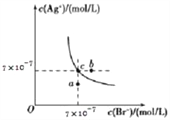
A. 在T℃时,AgBr的Ksp为4.9×10-13
B. 在AgBr的饱和溶液中加入NaBr固体,可使溶液由c点到b点
C. 图中a点对应的是含AgBr的不饱和溶液
D. 在T℃时,AgCl(s)+Br -(aq)![]() AgBr(s)+Cl -(aq)的平衡常数K≈408
AgBr(s)+Cl -(aq)的平衡常数K≈408
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置.
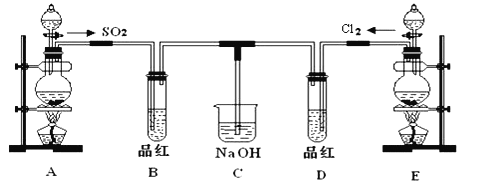
(1)实验室用装置A制备SO2某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是__________.
(2)实验室用装置E制备Cl2,其反应的化学方程式为__________;若有8mol的HCl参加反应,则转移的电子总数为__________.
(3)该装置中氢氧化钠溶液的作用是__________
(4)通气后B、D两个试管中的现象分别为B:________D:________.停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:______________D:___________.
(5)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现品红的颜色_________.请你分析该现象的原因(用化学方程式表示)__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知299 K时,合成氨反应N2(g ) + 3H2 ( g )![]() 2NH3( g ) △H =" -92.0" kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
2NH3( g ) △H =" -92.0" kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
A. 一定大于92.0 kJ B. 一定等于92.0 kJ
C. 一定小于92.0 kJ D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】框图中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。
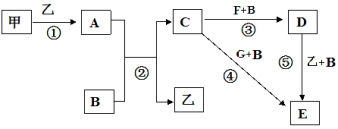
请问答下列问题:
(1)反应①-⑤中,既属于氧化还原反应又属于化合反应的是______________(填序号)。
(2)反应⑤的化学方程式为____________________________。
(3)甲与B反应的离子方程式 ______________________________。
(4)在实验室将C溶液滴入F溶液中,观察到的现象是_____________。
(5)在F溶液中加入等物质的量的A,发生反应的总的离子方程式为:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:

(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。在X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式是 。
②Y电极的材料是 ,电极反应式是 。
(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和碳的化合物在生产、生活中的应用非常广泛。 现将不同量的CO2(g)和H2(g)分别通入体积为2L的恒容密闭容器中,进行如下反应:CO2(g)+H2(g)![]() [Failed to download image : ]CO(g)+H2O(g),得到如下三组数据:
[Failed to download image : ]CO(g)+H2O(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
CO2 | H2 | CO | |||
1 | 800 | 4 | 2.5 | 1.5 | 5 |
2 | 830 | 2 | 2 | 1 | 3 |
3 | 830 | 2 | 2 | 1 | 1 |

(1)实验1中,平衡常数K=0.9;v(H2)=0.15mol/(Lmin)该反应的正反应为______(填“吸”或“放”)热反应;
(2)实验3跟实验2相比,改变的条件可能是___________________________
(答一种情况即可);若该反应符合图所示的关系,则在图中Y轴表示___________________________
(3)能判断该反应达到化学平衡状态的依据是______(多选扣分).
a.容器中压强不变 b.混合气体中c(CO )不变
c.v(H2)正=v(H2O)逆 d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)c(H2)=c(CO)c(H2O)由此可以判断此时的温度为______.其它条件不变,升高温度,原化学平衡向______反应方向移动(填“正”或“逆”),容器内混合气体的密度______(填“增大”、“减小”或“不变”).
(5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.80 mol·L-1 NaOH溶液475 mL 和0.40 mol·L-1硫酸500 mL。根据这两种溶液的配制情况回答下列问题:
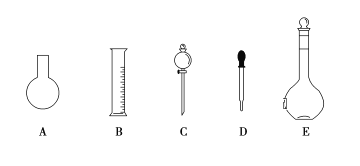
(1)如图所示的仪器中配制溶液肯定不需要的是____________(填序号),配制上述溶液还需用到的玻璃仪器是____________________(填仪器名称)。
(2)容量瓶所不具备的功能有________(填序号)。
A.配制一定体积准确浓度的标准溶液
B.量取一定体积的液体
C.测量容量瓶规格以下的任意体积的液体
D.贮存溶液
E.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为___________g。
(4)在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度________0.80 mol·L-1(填“大于”“等于”或“小于”,下同)。若还未等溶液冷却就定容了,则所得溶液浓度________0.80 mol·L-1。
(5)根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。如果实验室有10 mL、15 mL、20 mL、50 mL的量筒,最好选用________mL的量筒。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,如下图所示的装置中,若使活塞下移,重新达到平衡时,下列数值会增大的是

A. 阳离子数目 B. HCO3-的水解平衡常数 C. 溶液的pH D. c(HCO3-)/c(H2CO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com