
ΓΨΧβΡΩΓΩ‘ΎTΓφ ±Θ§AgBr‘ΎΥ°÷–ΒΡ≥ΝΒμ»ήΫβΤΫΚβ«ζœΏ»γΆΦΥυ ΨΓΘ”÷÷ΣTΓφ ±AgClΒΡKsp=2ΓΝ10 -10Θ§œ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «( )
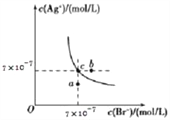
A. ‘ΎTΓφ ±Θ§AgBrΒΡKspΈΣ4.9ΓΝ10-13
B. ‘ΎAgBrΒΡ±ΞΚΆ»ή“Κ÷–Φ”»κNaBrΙΧΧεΘ§Ω… Ι»ή“Κ”…cΒψΒΫbΒψ
C. ΆΦ÷–aΒψΕ‘”ΠΒΡ «Κ§AgBrΒΡ≤Μ±ΞΚΆ»ή“Κ
D. ‘ΎTΓφ ±Θ§AgClΘ®sΘ©+Br -Θ®aqΘ©![]() AgBrΘ®sΘ©+Cl -Θ®aqΘ©ΒΡΤΫΚβ≥Θ ΐKΓ÷408
AgBrΘ®sΘ©+Cl -Θ®aqΘ©ΒΡΤΫΚβ≥Θ ΐKΓ÷408
ΓΨ¥πΑΗΓΩB
ΓΨΫβΈωΓΩA. ΨίΆΦΩ…÷ΣΘ§‘ΎTΓφ ±Θ§AgBrΒΡKsp= c(AgΘΪ)ΓΝc(BrΘ≠)=7ΓΝ10Θ≠7ΓΝ7ΓΝ10Θ≠7=4.9ΓΝ10Θ≠13Θ§Ι A’ΐ»ΖΘΜB. ‘ΎAgBrΒΡ±ΞΚΆ»ή“Κ÷–¥φ‘Ύ»ήΫβΤΫΚβΘΚAgBr(s) ![]() AgΘΪ(aq)+BrΘ≠(aq)Θ§Φ”»κNaBrΙΧΧεΘ§c(BrΘ≠)‘ω¥σΘ§AgBrΒΡ»ήΫβΤΫΚβΡφœρ“ΤΕ·Θ§c(AgΘΪ)Φθ–ΓΘ§Υυ“‘≤ΜΩ…Ρή Ι»ή“Κ”…cΒψ±δΒΫbΒψΘ§Ι B¥μΈσΘΜC. ΆΦ÷–aΒψΕ‘”ΠΒΡQc(AgBr)ΘΦKsp(AgBr)Θ§Υυ“‘aΒψΕ‘”ΠΒΡ «AgBrΒΡ≤Μ±ΞΚΆ»ή“ΚΘ§Ι C’ΐ»ΖΘΜD. ‘ΎTΓφ ±Θ§AgClΘ®sΘ©+Br-Θ®aqΘ©
AgΘΪ(aq)+BrΘ≠(aq)Θ§Φ”»κNaBrΙΧΧεΘ§c(BrΘ≠)‘ω¥σΘ§AgBrΒΡ»ήΫβΤΫΚβΡφœρ“ΤΕ·Θ§c(AgΘΪ)Φθ–ΓΘ§Υυ“‘≤ΜΩ…Ρή Ι»ή“Κ”…cΒψ±δΒΫbΒψΘ§Ι B¥μΈσΘΜC. ΆΦ÷–aΒψΕ‘”ΠΒΡQc(AgBr)ΘΦKsp(AgBr)Θ§Υυ“‘aΒψΕ‘”ΠΒΡ «AgBrΒΡ≤Μ±ΞΚΆ»ή“ΚΘ§Ι C’ΐ»ΖΘΜD. ‘ΎTΓφ ±Θ§AgClΘ®sΘ©+Br-Θ®aqΘ©![]() AgBrΘ®sΘ©+Cl-Θ®aqΘ©ΒΡΤΫΚβ≥Θ ΐK=
AgBrΘ®sΘ©+Cl-Θ®aqΘ©ΒΡΤΫΚβ≥Θ ΐK= ![]() =
= ![]() =
= ![]() =
= ![]() Γ÷408Θ§Ι D’ΐ»ΖΘΜ¥πΑΗ―ΓBΓΘ
Γ÷408Θ§Ι D’ΐ»ΖΘΜ¥πΑΗ―ΓBΓΘ



| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΫΪBaO2Ζ≈»κΟή±’ΒΡ’φΩ’»ίΤς÷–Θ§Ζ¥”Π2BaO2(s)![]() 2BaO(s)+O2(g)¥οΒΫΤΫΚβΓΘ±Θ≥÷Έ¬Ε»≤Μ±δΘ§Υθ–Γ»ίΤς»ίΜΐΘ§ΧεœΒ÷Ί–¬¥οΒΫΤΫΚβΘ§œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «Θ® Θ©
2BaO(s)+O2(g)¥οΒΫΤΫΚβΓΘ±Θ≥÷Έ¬Ε»≤Μ±δΘ§Υθ–Γ»ίΤς»ίΜΐΘ§ΧεœΒ÷Ί–¬¥οΒΫΤΫΚβΘ§œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «Θ® Θ©
A. ΤΫΚβ≥Θ ΐΦθ–Γ B. BaOΝΩ≤Μ±δ C. ―θΤχ―Ι«Ω≤Μ±δ D. BaO2ΝΩ‘ωΦ”
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
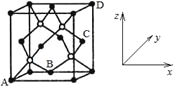
ΓΨΧβΡΩΓΩΒΣΓΔ―θΓΔΝρΓΔΝΉ «”κ…ζΟϋΜνΕ·Οή«–œύΙΊΒΡ‘ΣΥΊΓΘΜΊ¥πœ¬Ν–Έ ΧβΘΚ
(1)SO2Ζ÷Ή”ΒΡVSEPRΡΘ–ΆΟϊ≥Τ «____ΓΘ
(2)NΓΔOΓΔP»ΐ÷÷‘ΣΥΊΒΎ“ΜΒγάκΡή”…¥σΒΫ–ΓΒΡΥ≥–ρ «________ΓΘ
(3)ΤχΧ§«βΜ·ΈοΑ±(NH3)ΚΆλΔ(PH3)ΒΡΦϋΫ«Ϋœ¥σΒΡ «Θ®ΧνΜ·―ß ΫΘ©____Θ§‘≠“ρ «____ΓΘ
(4)SCNΘ≠÷–C‘≠Ή”ΒΡ‘”Μ·άύ–ΆΈΣ___‘”Μ·Θ§l mol SCNΘ≠÷–Κ§Π–ΦϋΒΡ ΐΡΩΈΣ____NAΓΘ
(5)ΨßΑϊ”–ΝΫΗωΜυ±Ψ“ΣΥΊΘΚ
ΔΌ‘≠”ηΉχ±ξ≤Έ ΐΘ§±μ ΨΨßΑϊΡΎ≤ΩΗς‘≠Ή”ΒΡœύΕ‘ΈΜ÷ΟΓΘΝΉΜ·≈π «“Μ÷÷≥§”≤ΡΆΡΞΒΡΆΩ≤ψ≤ΡΝœΘ§ΤδΨßΑϊΫαΙΙ»γΆΦΥυ ΨΘ§Τδ÷–‘≠Ή”Ήχ±ξ≤Έ ΐAΈΣ(0Θ§0Θ§0)ΘΜBΈΣΘ®1/2Θ§1/2Θ§0Θ©ΘΜDΈΣ(1Θ§1Θ§1)ΓΘ‘ρC‘≠Ή”ΒΡΉχ±ξ≤Έ ΐΈΣ____ΓΘ
ΔΎΨßΑϊ≤Έ ΐΘ§Οη ωΨßΑϊΒΡ¥σ–ΓΚΆ–ΈΉ¥ΓΘP‘≠Ή””κB‘≠Ή”ΒΡΉνΫϋΨύάκΈΣa cmΘ§‘ρΝΉΜ·≈πΨßΑϊΒΡ±Ώ≥ΛΈΣ____cm(”ΟΚ§aΒΡ¥ζ ΐ Ϋ±μ Ψ)ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΦΉ¥ΦΘ®CH3OHΘ© «“Μ÷÷÷Ί“ΣΒΡΜ·ΙΛ‘≠ΝœΘ§ΙψΖΚ”Π”Ο”ΎΜ·ΙΛ…ζ≤ζΘ§“≤Ω…“‘÷±Ϋ””ΟΉω»ΦΝœΓΘ
“―÷Σ
CH3OH(1) + O2(g) = CO(g) + 2H2O(g) ΓςH1 = Θ≠443.64 kJΓΛmolΘ≠1
2CO (g) + O2(g) = 2CO2(g) ΓςH2 = Θ≠566.0 kJΓΛmolΘ≠1
Θ®1Θ© ‘–¥≥ωCH3OH(1)‘Ύ―θΤχ÷–Άξ»Ϊ»Φ…’…ζ≥…CO2ΚΆH2OΘ®gΘ©ΒΡ»»Μ·―ßΖΫ≥Χ ΫΘΚ__________________________________________
Θ®2Θ©ΦΉ¥ΦΉςΈΣ»ΦΝœΘ§”≈Βψ «»Φ…’ ±≈≈Ζ≈ΒΡΈέ»ΨΈο…ΌΘ§¥”Εχ≤ΜΫωΡήΜΚΫβΡή‘¥Ϋτ’≈ΚΆΈ¬ “–ß”ΠΒΡΈ ΧβΘ§ΜΙΡήΗΡ…Τ¥σΤχ÷ ΝΩΓΘ ‘άϊ”ΟΘ®1Θ©÷–ΒΡ»»Μ·―ßΖΫ≥Χ ΫΦΤΥψΘ§Άξ»Ϊ»Φ…’16gΦΉ¥ΦΘ§…ζ≥…Εΰ―θΜ·ΧΦΚΆΥ°’τΤϊ ±Θ§Ζ≈≥ωΒΡ»»ΝΩΈΣ_____ kJ Θ§…ζ≥…ΒΡCO2ΤχΧε±ξΉΦΉ¥Ωωœ¬ΧεΜΐ «______LΓΘ
Θ®3Θ©ΩΤ―–»Υ‘±–¬ΫϋΩΣΖΔ≥ω“Μ÷÷”…ΦΉ¥ΦΚΆ―θΤχ“‘«ΩΦνΉωΒγΫβ÷ »ή“ΚΒΡ–¬–Ά ÷ΜζΒγ≥ΊΘ§Ω… Ι ÷ΜζΝ§–χ Ι”Ο“ΜΗω‘¬≤≈≥δ“Μ¥ΈΒγΘ§Ψί¥ΥΜΊ¥πœ¬Ν–Έ ΧβΘΚ
ΦΉ¥Φ‘Ύ______ΦΪΖ¥”ΠΘΜΒγΦΪΖ¥”Π ΫΈΣ____________________________________________ΓΘ
Θ®4Θ©Ρ≥Ά§―ß…ηΦΤΝΥ“Μ÷÷ΒγΫβΖ®÷Τ»ΓFe(OH)2ΒΡ Β―ιΉΑ÷ΟΘ®»γœ¬ΆΦΥυ ΨΘ©Θ§Ά®ΒγΚσΘ§»ή“Κ÷–≤ζ…ζ¥σΝΩΒΡΑΉ…Ϊ≥ΝΒμΘ§«“Ϋœ≥Λ ±Φδ≤Μ±δ…ΪΓΘ
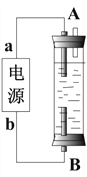
œ¬Ν–ΥΒΖ®÷–’ΐ»ΖΒΡ «___________Θ®Χν–ρΚ≈Θ©
AΘ°Βγ‘¥÷–ΒΡa“ΜΕ®ΈΣ’ΐΦΪΘ§b“ΜΕ®ΈΣΗΚΦΪ
BΘ°Ω…“‘”ΟNaCl »ή“ΚΉςΈΣΒγΫβ“Κ
CΘ°AΓΔBΝΫΕΥΕΦ±Ί–κ”ΟΧζΉςΒγΦΪ
DΘ°“θΦΪΖΔ…ζΒΡΖ¥”Π «ΘΚ2H+ + 2eΘ≠= H2Γϋ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ10Γφ ±Φ”»»NaHCO3±ΞΚΆ»ή“ΚΘ§≤βΒΟΗΟ»ή“ΚΒΡpHΖΔ…ζ»γœ¬±δΜ·ΘΚ
Έ¬Ε»Θ®ΓφΘ© | 10 | 20 | 30 | Φ”»»÷σΖ–Κσά以ΒΫ50Γφ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
ΗυΨί…œ ω ΐΨίΘΚΦΉΆ§―ß»œΈΣΘ§ΗΟ»ή“ΚΒΡpH…ΐΗΏΒΡ‘≠“ρ «HCO3Θ≠ΒΡΥ°Ϋβ≥ΧΕ»‘ω¥σΘ§Ι Φν–‘‘ω«ΩΘ§ΗΟΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ____________________________ΓΘ““Ά§―ß»œΈΣΘ§»ή“ΚpH…ΐΗΏΒΡ‘≠“ρ «NaHCO3 ή»»Ζ÷ΫβΘ§…ζ≥…ΝΥNa2CO3Θ§≤ΔΆΤΕœNa2CO3ΒΡΥ°Ϋβ≥ΧΕ»_______Θ®ΧνΓΑ¥σ”ΎΓ±ΜρΓΑ–Γ”ΎΓ±Θ©NaHCO3ΓΘ±ϊΆ§―ß»œΈΣΦΉΓΔ““ΒΡ≈–ΕœΕΦ≤Μ≥δΖ÷ΓΘ±ϊ»œΈΣΘΚ
Θ®1Θ©÷Μ“Σ‘ΎΦ”»»÷σΖ–ΒΡ»ή“Κ÷–Φ”»κΉψΝΩΒΡ ‘ΦΝXΘ§»τ≤ζ…ζ≥ΝΒμΘ§‘ρ____Θ®ΧνΓΑΦΉΓ±ΜρΓΑ““Γ±≈–Εœ’ΐ»ΖΓΘ ‘ΦΝX «_____________Θ®Χν–ρΚ≈Θ©ΓΘ
AΘ°Ba(OH)2»ή“Κ BΘ°BaCl2»ή“Κ CΘ°NaOH»ή“Κ DΘ°≥Έ«εΒΡ ·Μ“Υ°
Θ®2Θ©ΫΪΦ”»»ΚσΒΡ»ή“Κά以ΒΫ10ΓφΘ§»τ»ή“ΚΒΡpH_____(ΧνΓΑΗΏ”ΎΓ±ΓΔΓΑΒΆ”ΎΓ±ΜρΓΑΒ»”ΎΓ±Θ©8.3Θ§‘ρ_____Θ®ΧνΓΑΦΉΓ±ΜρΓΑ““Γ±Θ©≈–Εœ’ΐ»ΖΓΘ
Θ®3Θ©≤ι‘ΡΉ ΝœΘ§ΖΔœ÷NaHCO3ΒΡΖ÷ΫβΈ¬Ε»ΈΣ150ΓφΘ§±ϊΕœ―‘_____Θ®ΧνΓΑΦΉΓ±ΜρΓΑ““Γ±Θ©≈–Εœ «¥μΈσΒΡΘ§άμ”… «_____________________________________________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΗυΨί±μ÷––≈œΔ≈–ΕœΘ§œ¬Ν–―Γœν’ΐ»ΖΒΡ « (ΓΓ ΓΓ)
–ρΚ≈ | Ζ¥”ΠΈο | ≤ζΈο |
ΔΌ | KMnO4ΓΔH2O2ΓΔH2SO4 | K2SO4ΓΔMnSO4Γ≠ |
ΔΎ | Cl2ΓΔFeBr2 | FeCl3ΓΔFeBr3 |
Δέ | MnO | Cl2ΓΔMn2ΘΪΓ≠ |
A. ΒΎΔΌΉιΖ¥”ΠΒΡΤδ”ύ≤ζΈο÷Μ”–O2
B. ΒΎΔΎΉιΖ¥”Π÷–Cl2”κFeBr2ΒΡΈο÷ ΒΡΝΩ÷°±»ΈΣ1ΓΟ2
C. ΒΎΔέΉιΖ¥”Π÷–…ζ≥…1 mol Cl2Θ§ΉΣ“ΤΒγΉ”10 mol
D. ―θΜ·–‘”…«ΩΒΫ»θΥ≥–ρΈΣMnO![]() ΘΨCl2ΘΨFe3ΘΪΘΨBr2
ΘΨCl2ΘΨFe3ΘΪΘΨBr2
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΓΣΕ®Έ¬Ε»œ¬Θ§ΫΪ2molSO2ΚΆlmolO2≥δ»κ10LΚψ»ίΟή±’»ίΤς÷–Θ§ΖΔ…ζΖ¥”Π 2SO2(g) +O2(g) ![]() 2SO3(g) ΓςH=-196 kJmol-1Θ§5min ±¥οΒΫΤΫΚβΘ§≤βΒΟΖ¥”ΠΖ≈»»166.6 kJΓΘœ¬Ν–ΥΒΖ®¥μΈσΒΡ «
2SO3(g) ΓςH=-196 kJmol-1Θ§5min ±¥οΒΫΤΫΚβΘ§≤βΒΟΖ¥”ΠΖ≈»»166.6 kJΓΘœ¬Ν–ΥΒΖ®¥μΈσΒΡ «
A. 05 minΡΎΘ§”ΟO2±μ ΨΒΡΤΫΨυΖ¥”ΠΥΌ¬ v(O2)=0.017 molL-1 min-1
B. ![]() ΒΡ÷Β≤Μ±δ ±Θ§ΗΟΖ¥”Π¥οΒΫΤΫΚβΉ¥Χ§
ΒΡ÷Β≤Μ±δ ±Θ§ΗΟΖ¥”Π¥οΒΫΤΫΚβΉ¥Χ§
C. »τ‘ω¥σO2ΒΡ≈®Ε»Θ§SO2ΒΡΉΣΜ·¬ ‘ω¥σ
D. ΧθΦΰ≤Μ±δΘ§Τπ Φœρ»ίΤς÷–≥δ»κ4 mol SO2ΚΆ 2 mol O2Θ§ΤΫΚβ ±Ζ≈»»–Γ”Ύ333.2 kJ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ Ι2molN2ΚΆ6molH2ΜλΚœΖΔ…ζΖ¥”ΠΘΚN2(g)+3H2(s)![]() 2NH3(g)Θ§Θ®’ΐΖ¥”ΠΈΣΖ≈»»Ζ¥”ΠΘ©œ¬Ν–ΥΒΖ®¥μΈσΒΡ «
2NH3(g)Θ§Θ®’ΐΖ¥”ΠΈΣΖ≈»»Ζ¥”ΠΘ©œ¬Ν–ΥΒΖ®¥μΈσΒΡ «
A. …ΐΗΏΤΫΚβΧεœΒΒΡΈ¬Ε»Θ®±Θ≥÷ΧεΜΐ≤Μ±δΘ©Θ§ΜλΚœΤχΧεΒΡΤΫΨυœύΕ‘Ζ÷Ή”÷ ΝΩ±δ¥σ
B. …ΐΗΏΤΫΚβΧεœΒΒΡΈ¬Ε»Θ®±Θ≥÷ΧεΜΐ≤Μ±δΘ©Θ§ΜλΚœΤχΧεΒΡΟήΕ»≤Μ±δ
C. Β±Ζ¥”Π¥οΒΫΤΫΚβ ±Θ§N2ΚΆH2ΒΡ≈®Ε»±» «1ΓΟ3
D. Β±¥οΒΫΤΫΚβ ±Θ§≥δ»κκ≤ΤχΘ§≤Δ±Θ≥÷―Ι«Ω≤Μ±δΘ§ΤΫΚβΫΪΡφœρ“ΤΕ·
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ‘ΎΚψ»ίΟή±’»ίΤς÷–Θ§”…COΚœ≥…ΦΉ¥ΦΘΚCO(g)+2H2(g)![]() CH3OH(g)Θ§‘ΎΤδΥϊΧθΦΰ≤Μ±δΒΡ«ιΩωœ¬Θ§―–ΨΩΈ¬Ε»Ε‘Ζ¥”ΠΒΡ”ΑœλΘ§ Β―ιΫαΙϊ»γΆΦΥυ ΨΘ§œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
CH3OH(g)Θ§‘ΎΤδΥϊΧθΦΰ≤Μ±δΒΡ«ιΩωœ¬Θ§―–ΨΩΈ¬Ε»Ε‘Ζ¥”ΠΒΡ”ΑœλΘ§ Β―ιΫαΙϊ»γΆΦΥυ ΨΘ§œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
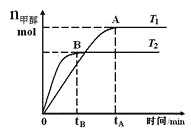
A. ΤΫΚβ≥Θ ΐK=![]()
B. ΗΟΖ¥”Π‘ΎT1 ±ΒΡΤΫΚβ≥Θ ΐ±»T2 ±ΒΡ–Γ
C. COΚœ≥…ΦΉ¥ΦΒΡΖ¥”ΠΈΣΈϋ»»Ζ¥”Π
D. ¥Π”ΎAΒψΒΡΖ¥”ΠΧεœΒ¥”T1±δΒΫT2Θ§¥οΒΫΤΫΚβ ±![]() ‘ω¥σ
‘ω¥σ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com