
����Ŀ�������¶��£���2molSO2��lmolO2����10L�����ܱ������У�������Ӧ 2SO2(g) +O2(g) ![]() 2SO3(g) ��H=-196 kJmol-1��5minʱ�ﵽƽ�⣬��÷�Ӧ����166.6 kJ������˵���������
2SO3(g) ��H=-196 kJmol-1��5minʱ�ﵽƽ�⣬��÷�Ӧ����166.6 kJ������˵���������
A. 05 min�ڣ���O2��ʾ��ƽ����Ӧ����v(O2)=0.017 molL-1 min-1
B. ![]() ��ֵ����ʱ���÷�Ӧ�ﵽƽ��״̬
��ֵ����ʱ���÷�Ӧ�ﵽƽ��״̬
C. ������O2��Ũ�ȣ�SO2��ת��������
D. �������䣬��ʼ�������г���4 mol SO2�� 2 mol O2��ƽ��ʱ����С��333.2 kJ
���𰸡�D
��������
A�����ʵ��������������ȣ�5minʱ�ﵽƽ�⣬��÷�Ӧ����166.6kJ����μӷ�Ӧ������Ϊ![]() =0.85mol��0��5min�ڣ���O2��ʾ��ƽ����Ӧ����v(O2)=
=0.85mol��0��5min�ڣ���O2��ʾ��ƽ����Ӧ����v(O2)=![]() =0.017molL-1min-1����A��ȷ��B.
=0.017molL-1min-1����A��ȷ��B.![]() �ı�ֵ����ʱ����֪�����ʵ����ʵ������䣬��Ӧ�ﵽƽ�⣬��B��ȷ��C��������O2��Ũ�ȣ�ƽ�������ƶ����ٽ����������ת������SO2��ת��������C��ȷ��D.2molSO2��1molO2����10L�����ܱ������дﵽƽ��ʱ����������Ϊ0.85mol���ų�����Ϊ166.6kJ�����������䣬��ʼ�������г���4molSO2��2molO2�����ʵ���Ϊԭ����2����ѹǿ����ƽ�������ƶ����ﵽƽ��ʱ������������0.85mol��2=1.7mol����ƽ��ʱ���ȴ���166.6kJ��2=333.2kJ����D����ѡD��
�ı�ֵ����ʱ����֪�����ʵ����ʵ������䣬��Ӧ�ﵽƽ�⣬��B��ȷ��C��������O2��Ũ�ȣ�ƽ�������ƶ����ٽ����������ת������SO2��ת��������C��ȷ��D.2molSO2��1molO2����10L�����ܱ������дﵽƽ��ʱ����������Ϊ0.85mol���ų�����Ϊ166.6kJ�����������䣬��ʼ�������г���4molSO2��2molO2�����ʵ���Ϊԭ����2����ѹǿ����ƽ�������ƶ����ﵽƽ��ʱ������������0.85mol��2=1.7mol����ƽ��ʱ���ȴ���166.6kJ��2=333.2kJ����D����ѡD��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ����ȷ����
A. ��Ba(OH)2��Һ����μ���NH4HS04��Һ���պó�����ȫ��Ba2++2OH-+H++SO42-+NH4+��BaSO4��+NH3��H2O+H2O
B. ��Mg(HC03)2��Һ�м�����������ʯ��ˮ��Mg2++2HCO3��+2Ca2++4OH����2CaCO3��+Mg(OH)2��+2H2O
C. ��������������Ʊ���Fe3++3H2O![]() Fe(OH)3(����)+3H+
Fe(OH)3(����)+3H+
D. ��״���½�112mL����ͨ��l0mL 1mol��L-l���廯������Һ�У�2Fe3++4Br��+3Cl2��2Fe2++2Br2+6Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼװ��������CO2��CO������岢���ͼ��a��c��dΪֹˮ�У�bΪ��Һ©��������ͨ��Y�ιܺ�ֹˮ�зֱ����������װ���ڿ������ž���Ϊʹʵ��ɹ����ס��ҡ����ֱ�ʢ�ŵ��Լ�Ϊ����
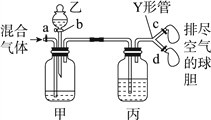
�� | �� | �� | |
A | ����NaHCO3��Һ | 12 mol��L��1���� | 18.4 mol��L��1 H2SO4 |
B | ����Na2CO3��Һ | 2 mol��L��1 H2SO4 | ����NaOH��Һ |
C | ����NaOH��Һ | 2 mol��L��1 H2SO4 | 18.4 mol��L��1 H2SO4 |
D | 18.4 mol��L��1 H2SO4 | ����NaOH��Һ | 18.4 mol��L��1 H2SO4 |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����T��ʱ��AgBr��ˮ�еij����ܽ�ƽ��������ͼ��ʾ����֪T��ʱAgCl��Ksp=2��10 -10������˵������ȷ����( )
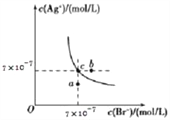
A. ��T��ʱ��AgBr��KspΪ4.9��10-13
B. ��AgBr�ı�����Һ�м���NaBr���壬��ʹ��Һ��c�㵽b��
C. ͼ��a���Ӧ���Ǻ�AgBr�IJ�������Һ
D. ��T��ʱ��AgCl��s��+Br -��aq��![]() AgBr��s��+Cl -��aq����ƽ�ⳣ��K��408
AgBr��s��+Cl -��aq����ƽ�ⳣ��K��408
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����98%��Ũ����(�ܶ�Ϊ1.84g/cm3)����l00mL 1mol/L��ϡ���ᣬ��窳���������(���ƹ����п����õ�):��100mL��Ͳ��10mL��Ͳ��50mL�ձ� ��������ƽ��100mL����ƿ����ͷ�ι�����������������ʹ���������Ⱥ����������ȷ����
A. �ܢۢߢݢ� B. �ڢݢߢ� C. �٢ۢݢޢ� D. �ڢޢۢߢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����һ���ݻ��̶��ĺ��������У������������һ������ܷ���壬��A��B��C���ֱ�����������X��H2��Y�������壬�����徲ֹʱ��A��C�ڵ������ܶ���ȣ�����˵����ȷ����

A. X����Է�����������Y����Է�������
B. X����Է���������Y����Է�������С
C. ����������V(X) ��V(H2)��V(Y)
D. ���ʵ�������n(X)< n(H2) <n(Y)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ͼһ��ʾ���ǿ��淴ӦCO(g)��H2(g) ![]() C(s)��H2O(g) ��H��0�Ļ�ѧ��Ӧ����(v)��ʱ��(t)�Ĺ�ϵ��ͼ����ʾ���ǿ��淴Ӧ2NO2(g)
C(s)��H2O(g) ��H��0�Ļ�ѧ��Ӧ����(v)��ʱ��(t)�Ĺ�ϵ��ͼ����ʾ���ǿ��淴Ӧ2NO2(g) ![]() N2O4(g) ��H��0��Ũ��(c)��ʱ��t�ı仯���������˵������ȷ����
N2O4(g) ��H��0��Ũ��(c)��ʱ��t�ı仯���������˵������ȷ����
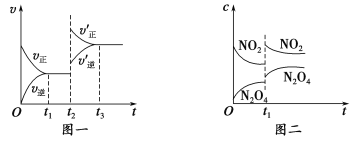
A��ͼһt2ʱ�ı�������������������¶Ȼ�ʹ���˴���
B����ͼһt2ʱ�ı������������ѹǿ����Ӧ�Ħ�H����
C��ͼ��t1ʱ�ı�������������������¶Ȼ�������ѹǿ
D����ͼ��t1ʱ�ı������������ѹǿ�����������ƽ����Է�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʵ��С���ͬѧΪ̽���ͱȽ�SO2����ˮ��Ư���ԣ���������µ�ʵ��װ��.
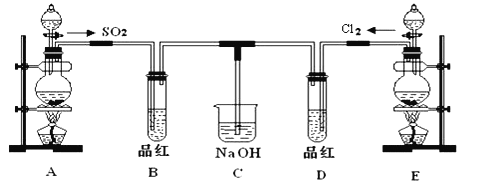
(1)ʵ������װ��A�Ʊ�SO2ijͬѧ��ʵ��ʱ���ִ�A�ķ�Һ©��������,©����Һ��δ����,����Ϊԭ�������__________.
(2)ʵ������װ��E�Ʊ�Cl2,�䷴Ӧ�Ļ�ѧ����ʽΪ__________;����8mol��HCl�μӷ�Ӧ,��ת�Ƶĵ�������Ϊ__________.
(3)��װ��������������Һ��������__________
(4)ͨ����B��D�����Թ��е�����ֱ�ΪB��________D��________.ֹͣͨ����,�ٸ�B��D�����Թֱܷ����,�����Թ��е�����ֱ�ΪB��______________D��___________.
(5)��һ��ʵ��С���ͬѧ��ΪSO2����ˮ����Ư���ԣ�����Ϻ��Ư���Կ϶����ǿ.���ǽ��Ƶõ�SO2��Cl2��1:1ͬʱͨ�뵽Ʒ����Һ�У��������Ʒ�����ɫ_________.��������������ԭ��(�û�ѧ����ʽ��ʾ)__________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼��̼�Ļ������������������е�Ӧ�÷dz��㷺�� �ֽ���ͬ����CO2��g����H2��g���ֱ�ͨ�����Ϊ2L�ĺ����ܱ������У��������·�Ӧ��CO2(g��+H2��g��![]() [Failed to download image : ]CO��g��+H2O��g�����õ������������ݣ�
[Failed to download image : ]CO��g��+H2O��g�����õ������������ݣ�
ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | |
CO2 | H2 | CO | |||
1 | 800 | 4 | 2.5 | 1.5 | 5 |
2 | 830 | 2 | 2 | 1 | 3 |
3 | 830 | 2 | 2 | 1 | 1 |

��1��ʵ��1�У�ƽ�ⳣ��K=0.9��v��H2��=0.15mol/��Lmin���÷�Ӧ������ӦΪ______��������š����ȷ�Ӧ��
��2��ʵ��3��ʵ��2��ȣ��ı������������___________________________
����һ��������ɣ������÷�Ӧ����ͼ��ʾ�Ĺ�ϵ������ͼ��Y���ʾ___________________________
��3�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������______����ѡ�۷֣���
a��������ѹǿ���� b�����������c��CO ������
c��v��H2����=v��H2O���� d��c��CO2��=c��CO��
��4��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��c��CO2��c��H2��=c��CO��c��H2O���ɴ˿����жϴ�ʱ���¶�Ϊ______�������������䣬�����¶ȣ�ԭ��ѧƽ����______��Ӧ�����ƶ�����������桱���������ڻ��������ܶ�______�����������С�����䡱����
��5��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com