
ЁОЬтФПЁПвбжЊЭМвЛБэЪОЕФЪЧПЩФцЗДгІCO(g)ЃЋH2(g) ![]() C(s)ЃЋH2O(g) ІЄHЃО0ЕФЛЏбЇЗДгІЫйТЪ(v)гыЪБМф(t)ЕФЙиЯЕЃЌЭМЖўБэЪОЕФЪЧПЩФцЗДгІ2NO2(g)
C(s)ЃЋH2O(g) ІЄHЃО0ЕФЛЏбЇЗДгІЫйТЪ(v)гыЪБМф(t)ЕФЙиЯЕЃЌЭМЖўБэЪОЕФЪЧПЩФцЗДгІ2NO2(g) ![]() N2O4(g) ІЄHЃМ0ЕФХЈЖШ(c)ЫцЪБМфtЕФБфЛЏЧщПіЁЃЯТСаЫЕЗЈжае§ШЗЕФЪЧ
N2O4(g) ІЄHЃМ0ЕФХЈЖШ(c)ЫцЪБМфtЕФБфЛЏЧщПіЁЃЯТСаЫЕЗЈжае§ШЗЕФЪЧ
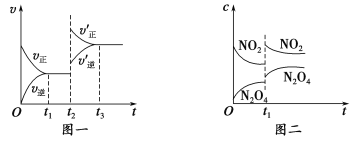
AЃЎЭМвЛt2ЪБИФБфЕФЬѕМўПЩФмЪЧЩ§ИпСЫЮТЖШЛђЪЙгУСЫДпЛЏМС
BЃЎШєЭМвЛt2ЪБИФБфЕФЬѕМўЪЧдіДѓбЙЧПЃЌдђЗДгІЕФІЄHдіДѓ
CЃЎЭМЖўt1ЪБИФБфЕФЬѕМўПЩФмЪЧЩ§ИпСЫЮТЖШЛђдіДѓСЫбЙЧП
DЃЎШєЭМЖўt1ЪБИФБфЕФЬѕМўЪЧдіДѓбЙЧПЃЌдђЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПНЋдіДѓ
ЁОД№АИЁПD
ЁОНтЮіЁП
ЪдЬтЗжЮіЃК AЁЂCO(g)ЃЋH2(g) ![]() C(s)ЃЋH2O(g) ІЄHЃО0ЃЌЩ§ИпЮТЖШЦНКте§ЯђНјааЃЌЕЋДпЛЏМСВЛИФБфЦНКтзДЬЌЃЌAДэЮѓЃЛBЁЂCO(g)ЃЋH2(g)
C(s)ЃЋH2O(g) ІЄHЃО0ЃЌЩ§ИпЮТЖШЦНКте§ЯђНјааЃЌЕЋДпЛЏМСВЛИФБфЦНКтзДЬЌЃЌAДэЮѓЃЛBЁЂCO(g)ЃЋH2(g)![]() C(s)ЃЋH2O(g)е§ЗДгІЪЧЬхЛ§МѕаЁЕФПЩФцЗДгІЃЌдђдіДѓбЙЧПЦНКтЯђе§ЗДгІЗНЯђНјааЃЌЕЋЗДгІШШгыЦНКтвЦЖЏЗНЯђУЛгаЙиЯЕЃЌBДэЮѓЃЛCЁЂ2NO2(g)
C(s)ЃЋH2O(g)е§ЗДгІЪЧЬхЛ§МѕаЁЕФПЩФцЗДгІЃЌдђдіДѓбЙЧПЦНКтЯђе§ЗДгІЗНЯђНјааЃЌЕЋЗДгІШШгыЦНКтвЦЖЏЗНЯђУЛгаЙиЯЕЃЌBДэЮѓЃЛCЁЂ2NO2(g) ![]() N2O4(g) ІЄHЃМ0ЃЌЩ§ИпСЫЮТЖШЃЌЦНКтФцЯђвЦЖЏЃЌt1ЪБПЬКѓcЃЈNO2ЃЉж№НЅдіДѓЃЌcЃЈN2O4ЃЉж№НЅМѕаЁЃЌCДэЮѓЃЛDЁЂгЩ
N2O4(g) ІЄHЃМ0ЃЌЩ§ИпСЫЮТЖШЃЌЦНКтФцЯђвЦЖЏЃЌt1ЪБПЬКѓcЃЈNO2ЃЉж№НЅдіДѓЃЌcЃЈN2O4ЃЉж№НЅМѕаЁЃЌCДэЮѓЃЛDЁЂгЩ![]() ЃЌЖдЗДгІ2NO2(g)
ЃЌЖдЗДгІ2NO2(g)![]() N2O4(g)ЃЌдіДѓбЙЧПЃЌЦНКте§ЯђвЦЖЏЃЌ
N2O4(g)ЃЌдіДѓбЙЧПЃЌЦНКте§ЯђвЦЖЏЃЌ![]() МѕаЁЃЌ
МѕаЁЃЌ![]() гІИУдіДѓЃЌDе§ШЗЃЌД№АИбЁDЁЃ
гІИУдіДѓЃЌDе§ШЗЃЌД№АИбЁDЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉПЦбЇМвЗЂЯжЃЌЪГгУЯКРрЕШЫЎЩњМзПЧРрЖЏЮяЕФЭЌЪБЗўгУЮЌЩњЫиCШнвзжаЖОЃЌетЪЧвђЮЊЖдШЫЬхЮоКІЕФ+5МлЩщРрЛЏКЯЮядкЮЌЩњЫиCЕФзїгУЯТФмЙЛзЊЛЏЮЊгаЖОЕФ+3МлЕФКЌЩщЛЏКЯЮяЁЃЭЈЙ§вдЩЯаХЯЂЬюПеЃКЩЯЪіЙ§ГЬжа+5МлЩщРрЮяжЪзїЮЊ______ЃЈЬюбѕЛЏМСЛђЛЙдМСЃЉЃЌ+5МлЩщдЊЫиЗЂЩњ______ЗДгІЃЈЬюбѕЛЏЛђЛЙдЃЉЃЛ0.5mol+5МлЩщЭъШЋзЊЛЏЮЊ+3МлЩщЃЌЙВзЊвЦ______ИіЕчзгЁЃ
ЃЈ2ЃЉЪЕбщЪвГЃгУвдЯТЗНЗЈжЦШЁТШЦјЃКMnO2+4HCl(ХЈ)![]() MnCl2+Cl2Ёќ+2H2OЁЃ
MnCl2+Cl2Ёќ+2H2OЁЃ
ЂйгУЫЋЯпЧХБъГіЕчзгзЊвЦЗНЯђКЭЪ§ФП______ЃЛЃЈдкД№ЬтжНЩЯБъЃЉ
ЂкдкБъзМзДПіЯТЩњГЩЕФТШЦјЮЊ11.2LЪБЃЌБЛбѕЛЏЕФHClЕФжЪСПЮЊ______ЃЛ
ЂлЮЊБЃжЄЪЕбщАВШЋЃЌГЃгУЧтбѕЛЏФЦШмвКЮќЪеЖргрЕФТШЦјЃЌаДГіЗДгІЕФРызгЗНГЬЪН______________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП10ЁцЪБМгШШNaHCO3БЅКЭШмвКЃЌВтЕУИУШмвКЕФpHЗЂЩњШчЯТБфЛЏЃК
ЮТЖШЃЈЁцЃЉ | 10 | 20 | 30 | МгШШжѓЗаКѓРфШДЕН50Ёц |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
ИљОнЩЯЪіЪ§ОнЃКМзЭЌбЇШЯЮЊЃЌИУШмвКЕФpHЩ§ИпЕФдвђЪЧHCO3ЃЕФЫЎНтГЬЖШдіДѓЃЌЙЪМюаддіЧПЃЌИУЗДгІЕФРызгЗНГЬЪНЮЊ____________________________ЁЃввЭЌбЇШЯЮЊЃЌШмвКpHЩ§ИпЕФдвђЪЧNaHCO3ЪмШШЗжНтЃЌЩњГЩСЫNa2CO3ЃЌВЂЭЦЖЯNa2CO3ЕФЫЎНтГЬЖШ_______ЃЈЬюЁАДѓгкЁБЛђЁАаЁгкЁБЃЉNaHCO3ЁЃБћЭЌбЇШЯЮЊМзЁЂввЕФХаЖЯЖМВЛГфЗжЁЃБћШЯЮЊЃК
ЃЈ1ЃЉжЛвЊдкМгШШжѓЗаЕФШмвКжаМгШызуСПЕФЪдМСXЃЌШєВњЩњГСЕэЃЌдђ____ЃЈЬюЁАМзЁБЛђЁАввЁБХаЖЯе§ШЗЁЃЪдМСXЪЧ_____________ЃЈЬюађКХЃЉЁЃ
AЃЎBa(OH)2ШмвК BЃЎBaCl2ШмвК CЃЎNaOHШмвК DЃЎГЮЧхЕФЪЏЛвЫЎ
ЃЈ2ЃЉНЋМгШШКѓЕФШмвКРфШДЕН10ЁцЃЌШєШмвКЕФpH_____(ЬюЁАИпгкЁБЁЂЁАЕЭгкЁБЛђЁАЕШгкЁБЃЉ8.3ЃЌдђ_____ЃЈЬюЁАМзЁБЛђЁАввЁБЃЉХаЖЯе§ШЗЁЃ
ЃЈ3ЃЉВщдФзЪСЯЃЌЗЂЯжNaHCO3ЕФЗжНтЮТЖШЮЊ150ЁцЃЌБћЖЯбд_____ЃЈЬюЁАМзЁБЛђЁАввЁБЃЉХаЖЯЪЧДэЮѓЕФЃЌРэгЩЪЧ_____________________________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЁЊЖЈЮТЖШЯТЃЌНЋ2molSO2КЭlmolO2ГфШы10LКуШнУмБеШнЦїжаЃЌЗЂЩњЗДгІ 2SO2(g) +O2(g) ![]() 2SO3(g) ЁїH=-196 kJmol-1ЃЌ5minЪБДяЕНЦНКтЃЌВтЕУЗДгІЗХШШ166.6 kJЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧ
2SO3(g) ЁїH=-196 kJmol-1ЃЌ5minЪБДяЕНЦНКтЃЌВтЕУЗДгІЗХШШ166.6 kJЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧ
A. 05 minФкЃЌгУO2БэЪОЕФЦНОљЗДгІЫйТЪv(O2)=0.017 molL-1 min-1
B. ![]() ЕФжЕВЛБфЪБЃЌИУЗДгІДяЕНЦНКтзДЬЌ
ЕФжЕВЛБфЪБЃЌИУЗДгІДяЕНЦНКтзДЬЌ
C. ШєдіДѓO2ЕФХЈЖШЃЌSO2ЕФзЊЛЏТЪдіДѓ
D. ЬѕМўВЛБфЃЌЦ№ЪМЯђШнЦїжаГфШы4 mol SO2КЭ 2 mol O2ЃЌЦНКтЪБЗХШШаЁгк333.2 kJ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПAЁЂBЁЂCЁЂDЁЂEЮхжжЮяжЪЕФбцЩЋЗДгІЖМГЪЛЦЩЋЃЌAЁЂBгыЫЎЗДгІЖМгаЦјЬхЗХГіЃЌAгыЫЎЗДгІЗХГіЕФЦјЬхОпгаЛЙдадЃЌBгыЫЎЗДгІЗХГіЕФЦјЬхОпгабѕЛЏадЃЌЭЌЪБЖМЩњГЩШмвКCЃЌCгыЪЪСПЕФCO2ЗДгІЩњГЩDЃЌDШмвКгыЙ§СПЕФCO2ЗДгІЩњГЩEЃЌEМгШШФмЩњГЩD.
ЂХаДГіЯТСаЮяжЪЕФЛЏбЇЪНЃКB______E______D______
ЂЦаДГіAЁњCЕФЛЏбЇЗНГЬЪН,ВЂБъГіЕчзгзЊвЦЕФЗНЯђКЭЪ§ФПЃК__________ЁЃ
ЂЧаДГіCЁњDЕФРызгЗНГЬЪНЃК_______________
ЂШаДГіЛЏбЇЗНГЬЪНЃКEЃЋB![]() DЃЋCЃЋO2ЁќЃК_____________.
DЃЋCЃЋO2ЁќЃК_____________.
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪЙ2molN2КЭ6molH2ЛьКЯЗЂЩњЗДгІЃКN2(g)+3H2(s)![]() 2NH3(g)ЃЌЃЈе§ЗДгІЮЊЗХШШЗДгІЃЉЯТСаЫЕЗЈДэЮѓЕФЪЧ
2NH3(g)ЃЌЃЈе§ЗДгІЮЊЗХШШЗДгІЃЉЯТСаЫЕЗЈДэЮѓЕФЪЧ
A. Щ§ИпЦНКтЬхЯЕЕФЮТЖШЃЈБЃГжЬхЛ§ВЛБфЃЉЃЌЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПБфДѓ
B. Щ§ИпЦНКтЬхЯЕЕФЮТЖШЃЈБЃГжЬхЛ§ВЛБфЃЉЃЌЛьКЯЦјЬхЕФУмЖШВЛБф
C. ЕБЗДгІДяЕНЦНКтЪБЃЌN2КЭH2ЕФХЈЖШБШЪЧ1ЁУ3
D. ЕБДяЕНЦНКтЪБЃЌГфШыыВЦјЃЌВЂБЃГжбЙЧПВЛБфЃЌЦНКтНЋФцЯђвЦЖЏ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП25 ЁцЪБ,дк20 mL 0.1 molЁЄL-1NaOHШмвКжаж№ЕЮМгШы0.2 molЁЄL-1ДзЫсШмвК,ЧњЯпШчЭМЫљЪО,гаЙиСЃзгХЈЖШЙиЯЕЕФБШНЯжа,ВЛе§ШЗЕФЪЧ( )
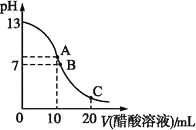
A. дкAЕу:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B. дкBЕу:c(OH-)=c(H+),c(Na+)=c(CH3COO-)
C. дкCЕу:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D. дкCЕу:c(CH3COO-)+c(CH3COOH)=2c(Na+)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПClO2ЪЧвЛжжЯћЖОЩБОњаЇТЪИпЁЂЖўДЮЮлШОаЁЕФЫЎДІРэМСЁЃЪЕбщЪвПЩЭЈЙ§вдЯТЗДгІжЦЕУClO2ЃК2KClO3ЃЋH2C2O4ЃЋH2SO4![]() 2ClO2ЁќЃЋK2SO4ЃЋ2CO2ЁќЃЋ2H2OЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ( )
2ClO2ЁќЃЋK2SO4ЃЋ2CO2ЁќЃЋ2H2OЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ( )
AЃЎClO2ЪЧбѕЛЏВњЮя
BЃЎKClO3дкЗДгІжаЕУЕНЕчзг
CЃЎH2C2O4дкЗДгІжаБЛЛЙд
DЃЎ1 mol KClO3ВЮМгЗДгІга2 molЕчзгзЊвЦ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЛЖЈЮТЖШЯТЃЌЯђШнЛ§ЙЬЖЈЮЊa LЕФУмБеШнЦїжаГфШы1 mol XЦјЬхКЭ2 mol YЦјЬхЃЌЗЂЩњЗДгІX(g)ЃЋ2Y(g) ![]() 2Z(g)ЃЌДЫЗДгІДяЕНЦНКтзДЬЌЕФБъжОЪЧ(ЁЁЁЁ)
2Z(g)ЃЌДЫЗДгІДяЕНЦНКтзДЬЌЕФБъжОЪЧ(ЁЁЁЁ)
A. ШнЦїФкЦјЬхУмЖШВЛЫцЪБМфБфЛЏ B. ШнЦїФкИїЮяжЪЕФХЈЖШВЛЫцЪБМфБфЛЏ
C. ШнЦїФкXЁЂYЁЂZЕФХЈЖШжЎБШЮЊ1ЁУ2ЁУ2 D. ЕЅЮЛЪБМфФкЯћКФ0.1 mol XЃЌЭЌЪБЩњГЩ0.2 mol Z
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com