
【题目】A、B、C、D、E五种物质的焰色反应都呈黄色,A、B与水反应都有气体放出,A与水反应放出的气体具有还原性,B与水反应放出的气体具有氧化性,同时都生成溶液C,C与适量的CO2反应生成D,D溶液与过量的CO2反应生成E,E加热能生成D.
⑴写出下列物质的化学式:B______E______D______
⑵写出A→C的化学方程式,并标出电子转移的方向和数目:__________。
⑶写出C→D的离子方程式:_______________
⑷写出化学方程式:E+B![]() D+C+O2↑:_____________.
D+C+O2↑:_____________.
【答案】Na2O2 NaHCO3 Na2CO3 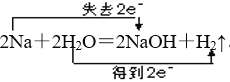 CO2+2OH-=CO32+H2O。 2NaHCO3+2Na2O2=2Na2CO3+2NaOH+O2↑
CO2+2OH-=CO32+H2O。 2NaHCO3+2Na2O2=2Na2CO3+2NaOH+O2↑
【解析】
A、B、C、D、E五种物质的焰色反应都显黄色,说明都含有钠元素,A、B与水反应都有气体放出,且A与水反应放出的气体具有还原性,B与水反应放出的气体具有氧化性,说明A是Na,B是Na2O2,A、B与水反应都生成溶液C,C为NaOH,NaOH与适量CO2反应会生成Na2CO3,Na2CO3与过量的CO2反应会生成NaHCO3,E加热能生成D,D为Na2CO3,E为NaHCO3,所以,A~E的化学式:A:Na、B:Na2O2、C:NaOH、D:Na2CO3、E:NaHCO3。
(1)由分析可以知道,B为Na2O2, D为Na2CO3,E为NaHCO3,故答案为:Na2O2,NaHCO3,Na2CO3。
(2)A为Na,C为NaOH,A→C的化学方程式并标出电子转移的方向和数目: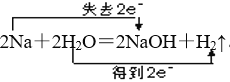 ,故答案为:
,故答案为: 。
。
(3)C为NaOH,D为Na2CO3,C→D的离子方程式为:CO2+2OH-=CO32+H2O,故答案为:CO2+2OH-=CO32+H2O。
(4)B为Na2O2,E为NaHCO3,Na2O2与NaHCO3反应生成碳酸钠、氢氧化钠和氧气,反应方程式为:2NaHCO3+2Na2O2=2Na2CO3+2NaOH+O2↑,故答案为:2NaHCO3+2Na2O2=2Na2CO3+2NaOH+O2↑。


科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值,下列判断正确的是
A. 高温下,5.6 g Fe与足量水蒸气反应,转移的电子数为0.3NA
B. 标准状况下,22.4 L NO和11.2 L O2充分反应,产物的分子数为NA
C. 60g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C-O键数目为NA
D. 向含有0.2 mol NH4Al(SO4)2的溶液中滴加NaOH 溶液至沉淀恰好完全溶解,所消耗OH-的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84g/cm3)配制l00mL 1mol/L的稀硫酸,现绐出下列仪器(配制过程中可能用到):①100mL量筒②10mL量筒③50mL烧杯 ④托盘天平⑤100mL容量瓶⑥胶头滴管⑦玻璃棒,配制中使用仪器的先后順序排列正确的是
A. ④③⑦⑤⑥ B. ②⑤⑦⑥ C. ①③⑤⑥⑦ D. ②⑥③⑦⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρgcm-3,溶质的质量分数为![]() ,溶质的物质的量浓度为c mol/L。下列叙述中正确的是
,溶质的物质的量浓度为c mol/L。下列叙述中正确的是
A. ![]()
B. ![]()
C. 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5![]()
D. 上述溶液中再加入同体积同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c (Cl-)>c(NH4+)>c (OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知图一表示的是可逆反应CO(g)+H2(g) ![]() C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g) ![]() N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的是
N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的是
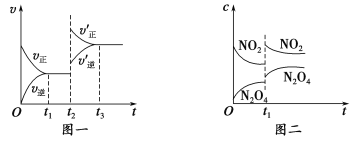
A.图一t2时改变的条件可能是升高了温度或使用了催化剂
B.若图一t2时改变的条件是增大压强,则反应的ΔH增大
C.图二t1时改变的条件可能是升高了温度或增大了压强
D.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理具有极为广泛的应用,请回答下列问题:
(1)电镀是防止金属腐蚀的重要方法,铁制品表面上镀铜的装置示意图如图所示:
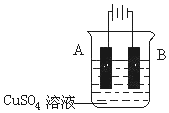
①A电极对应的金属是__________(写元素名称)。
②电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为a g,则电镀时电路中通过的电子为_________mol。
(2)工业上常用电解熔融氯化镁获得金属镁,若电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率,写出生成MgO 的化学方程式_________________。
(3)“镁-次氯酸盐”燃料电池的装置如图所示:
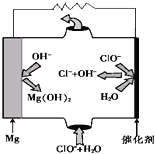
①该电池的正极反应式为__________________。
②若用该电池为电源,用惰性电极电解CuSO4溶液,电解一段时间后,向电解液中加入0.1mol Cu2(OH)2CO3,恰好使溶液恢复到电解前的浓度和pH。电解过程产生的气体体积(在标准状况下)为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 稀H2SO4 滴在铁片上:2Fe+6H+![]() 2Fe3++3H2↑
2Fe3++3H2↑
B. 稀盐酸滴在碳酸钙上:CO32―+2H+![]() CO2↑+H2O
CO2↑+H2O
C. 硫酸与氢氧化钡溶液混合:Ba2++SO42-![]() BaSO4↓
BaSO4↓
D. 氧化铜与盐酸反应:CuO +2H+![]() Cu2++H2O
Cu2++H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com