
【题目】一定温度下,在3个体积均为1.0L的恒容密闭容器中反应2SO2(g)+O2(g)![]() 2SO3(g)达到平衡。下列说法正确的是
2SO3(g)达到平衡。下列说法正确的是
容器 | 温度/K | 物质的起始浓度/mol/L | 物质的平衡浓度/mol/L | SO2或SO3平衡转化率 | ||
c(SO2) | c(O2) | c(SO3) | c(SO3) | |||
I | 723 | 0.2 | 0.1 | 0 | 0.16 | a1 |
II | 723 | 0.4 | 0.2 | 0 | a2 | |
III | 823 | 0 | 0 | 0.2 | a3 | |
A. 达到平衡时,a1+a3>1
B. 达到平衡时,容器中的压强: PII>PI>PIII
C. 达到平衡时,容器III中的逆反应速率比容器I中的大
D. 若起始时,向容器I中充入0.16molSO2、0.04molO2和0.16molSO3,则此时反应向逆反应方向进行
【答案】AC
【解析】容器I、II由正反应开始建立平衡,容器III由逆反应开始建立平衡。设计容器IV,容器IV为723K,起始向1.0L的恒容密闭容器中加入0.2mol/LSO3(g),则容器IV达到的平衡状态与容器I为完全全等的等效平衡,平衡时容器IV中SO3的转化率与容器I中SO2的转化率之和为1,平衡时PI=PIV。A,由于该反应的正反应为放热反应,容器III相当于在容器IV达到平衡后升高温度,平衡向逆反应方向移动,SO3的转化率增大,即容器III中SO3的平衡转化率大于容器IV,则a1+a3![]() 1,A项正确;B,容器I和容器II温度相同,容器II起始SO2、O2物质的量浓度都是容器I的两倍,容器II起始压强为容器I起始压强的两倍,容器II相当于在容器I达到平衡后增大压强,平衡向正反应方向移动,达平衡时2PI
1,A项正确;B,容器I和容器II温度相同,容器II起始SO2、O2物质的量浓度都是容器I的两倍,容器II起始压强为容器I起始压强的两倍,容器II相当于在容器I达到平衡后增大压强,平衡向正反应方向移动,达平衡时2PI![]() PII
PII![]() PI,容器III相当于在容器IV达到平衡后升高温度,平衡向逆反应方向移动,达平衡时PIII
PI,容器III相当于在容器IV达到平衡后升高温度,平衡向逆反应方向移动,达平衡时PIII![]() PIV,PI=PIV,则PIII
PIV,PI=PIV,则PIII![]() PI,B项错误;C,容器III中温度高于容器IV中,平衡时容器III中逆反应速率比容器IV中的大,平衡时容器IV中逆反应速率与容器I中的相等,平衡时容器III中逆反应速率比容器I中的大,C项正确;D,容器I平衡时c(SO3)=0.16mol/L,用三段式
PI,B项错误;C,容器III中温度高于容器IV中,平衡时容器III中逆反应速率比容器IV中的大,平衡时容器IV中逆反应速率与容器I中的相等,平衡时容器III中逆反应速率比容器I中的大,C项正确;D,容器I平衡时c(SO3)=0.16mol/L,用三段式
2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
c(起始)(mol/L) 0.2 0.1 0
c(转化)(mol/L) 0.16 0.08 0.16
c(平衡)(mol/L) 0.04 0.02 0.16
723K时化学平衡常数K=![]() =
=![]() =800,若起始时向容器I中充入0.16molSO2、0.04molO2和0.16molSO3,此时SO2、O2、SO3物质的量浓度依次为0.16mol/L、0.04mol/L、0.16mol/L,浓度商Qc=
=800,若起始时向容器I中充入0.16molSO2、0.04molO2和0.16molSO3,此时SO2、O2、SO3物质的量浓度依次为0.16mol/L、0.04mol/L、0.16mol/L,浓度商Qc=![]() =
=![]() =25
=25![]() 800,此时反应向正反应方向进行,D项错误;答案选AC。
800,此时反应向正反应方向进行,D项错误;答案选AC。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】
以有机物A 合成聚酯类高分子化合物F 的路线如下:

已知: 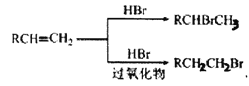
(1) A生成B 的反应类型为_________,C 中官能团的名称为__________ 。
(2) D 与NaOH 水溶液反应的化学方程式为__________ 。
(3) ①E 生成F 的化学方程式为__________。
②若F的平均相对分子质量为20000,则其平均聚合度为________ (填选项字母)。
A.54 B.108 C.119 D.133
(4) E 在一定条件下还可以合成含有六元环结构的G,G 的结构简式为__________。
(5) 满足下列条件的C 的同分异构体有___种(不考虑立体异构)。
①含有1个六元碳环,且环上相邻4 个碳原子上各连有一个取代基
②1mol 该物质与新制氢氧化铜悬浊液反应产生2mol 砖红色沉淀
(6) 写出以![]() 为原料(其他试剂任选) 制备化合物
为原料(其他试剂任选) 制备化合物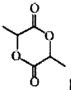 的合成路线,请用以下方式表示:
的合成路线,请用以下方式表示: 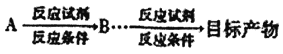 。___________________。
。___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 向氢氧化钡溶液中加入硫酸氢钠至溶液为中性:Ba2++2OH-+2H++SO42-==BaSO4↓+2H2O
B. 电解氯化镁溶液:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C. 氯气与水反应:Cl2+H2O==2H++Cl-+ClO-
D. 向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH-==CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 电离能大的元素,不易失电子,易得到电子,表现非金属性
B. 电离能大的元素其电负性必然也大
C. 电负性最大的非金属元素形成的含氧酸的酸性最强
D. 电离能最小的元素形成的氧化物的水化物的碱性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鉴别固体Na2CO3和NaHCO3的最好方法是( )
A.分别与同浓度的稀盐酸反应
B.分别加入NaOH溶液
C.分别加入石灰水
D.溶于水,比较其溶解性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiSO46H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Fe、Cr等杂质)为原料获得。工艺流程如下图:

已知:25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表所示。
Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | Ni(OH)2 | |
Ksp | 8.0×10—16 | 4.0×10—38 | 6.0×10—31 | 6.5×10—18 |
完全沉淀pH | ≥9.6 | ≥3.2 | ≥5.6 | ≥8.4 |
注:NiCO3是一种不溶于水易溶于强酸的沉淀。
请回答下列问题:
(1)下列措施可行,且能提高废渣浸出率的有 。
A.升高反应温度 B.增大压强 C.在反应过程中不断搅拌
(2)在滤液Ⅰ中加入6%的H2O2,其作用是 (用离子方程式表示);
加入NaOH调节pH的范围是 ,为了除去溶液中的 离子。
(3)滤液Ⅱ的主要成分是 。
(4)检验Ni2+已完全沉淀的实验方法是 。
(5)操作Ⅰ的实验步骤依次为:
① ;
② ;
③蒸发浓缩、冷却结晶,过滤得NiSO46H2O晶体;
④用少量乙醇洗涤NiSO46H2O晶体并晾干。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图实验室某浓盐酸试剂瓶标签上的有关数据,下列说法正确的是

A. 该浓盐酸中HCl的物质的量浓度为11.9mol·L-1
B. 溶液中HCl的物质的量不随所取体积的多少而变化
C. 配制500 mL0.400 mol·L-1的稀盐酸需要量取浓盐酸1.68mL
D. 中和含0.4 g NaOH的NaOH溶液需取0.400 mol·L-1的稀盐酸2.5 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硝酸的认识中,正确的是( )
A.浓硝酸在常温下光照和受热都会分解
B.浓硝酸与金属反应不放出氢气,而稀硝酸与金属反应可置换出氢气
C.常温下,因为铝和铁不与浓硝酸反应,所以浓硝酸可盛放在铝制或铁制容器中
D.铜分别与浓硝酸、稀硝酸反应生成NO2和NO,故稀硝酸的氧化性大于浓硝酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com