
【题目】NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等。可由电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得。工艺流程如下图:
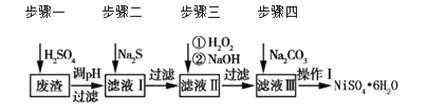
请回答下列问题:
(1)用稀硫酸溶解废渣时,为了提高浸取率可采取的措施有_______(任写一点)。
(2)向滤液中滴入适量的Na2S溶液,目的是除去Cu2+、Zn2+,写出除去Cu2+的离子方程式________。
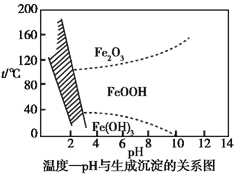
(3)在40 ℃左右,用6%的H2O2氧化Fe2+,再在95 ℃时加入NaOH调节pH,除去铁和铬。此外,还常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠![]() (OH)12]沉淀除去。如图是温度—pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域[已知25 ℃时,Fe(OH)3的Ksp=2.64×10-39]。下列说法正确的是_______(选填序号)。
(OH)12]沉淀除去。如图是温度—pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域[已知25 ℃时,Fe(OH)3的Ksp=2.64×10-39]。下列说法正确的是_______(选填序号)。
a.FeOOH中铁为+2价
b.若在25 ℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10-29
c.用氯酸钠在酸性条件下氧化Fe2+的离子方程式为:6Fe2++Cl![]() +6H+
+6H+![]() 6Fe3++Cl-+3H2O
6Fe3++Cl-+3H2O
d.工业生产中常保持在85~95 ℃生成黄铁矾钠,此时水体的pH为1.2~1.8
(4)上述流程中滤液Ⅲ的主要成分是_______。
(5)确定步骤四中Na2CO3溶液足量,碳酸镍已完全沉淀的简单实验方法是_______。
(6)操作Ⅰ的实验步骤依次为(实验中可选用的试剂:6 mol·L-1的H2SO4溶液、蒸馏水、pH试纸):
①___________;
②___________;
③蒸发浓缩、冷却结晶,过滤得NiSO4·6H2O晶体;
④用少量乙醇洗涤NiSO4·6H2O晶体并晾干。
【答案】加热或搅拌或增大硫酸浓度等 Cu2++S2-![]() CuS↓ cd NiSO4 上层清液呈无色 过滤,并用蒸馏水洗净沉淀 向沉淀中加6 mol·L-1的H2SO4溶液,直至恰好完全溶解
CuS↓ cd NiSO4 上层清液呈无色 过滤,并用蒸馏水洗净沉淀 向沉淀中加6 mol·L-1的H2SO4溶液,直至恰好完全溶解
【解析】
废渣(除含镍外,还含有Cu、Zn、Fe、Cr等元素的化合物杂质),在硫酸溶解调节pH后过滤后除去不溶于铁离子,滤液含有二价铁离子、三价铬离子、铜离子、锌离子等杂质,加入硫化钠可除去铜离子、锌离子,然后加H2O2是将二价铁氧化成三价铁,再通过调节pH值2~4使三价铁和三价铬都以氢氧化物的沉淀而除去,滤液Ⅲ含有可溶性硫酸盐,为Na2SO4、NiSO4,再加碳酸钠沉淀二价镍,过滤、洗涤,然后与硫酸反应生成NiSO4晶体;
(1)搅拌固体和液体的混合物,升高温度、增大浓度等,可加快反应速率;
(2)加Na2S,易生成CuS沉淀;
(3)a.根据化合价的代数和为零分析;
b.pH=4,c(OH-)=1×10-10 molL-1,根据Ksp计算铁离子的浓度;
c.用氯酸钠在酸性条件下氧化Fe2+生成铁离子和氯离子;
d.根据图象判断生成黄铁矾钠的条件;
(4)经过加入Na2S、H2O2、NaOH后可除去Cu、Zn、Fe、Cr等化合物的杂质,滤液中含有可溶性硫酸盐;
(5)含有Ni2+的溶液显绿色;
(6)向含有NiSO4溶液中加碳酸钠,得到NiCO3沉淀,过滤、洗涤,向沉淀中加硫酸溶解,得到NiSO4溶液,再经过蒸发浓缩、冷却结晶、过滤、洗涤等操作得NiSO46H2O晶体。
(1)提高浸取率可采取将废渣粉碎、加热、搅拌以及增大硫酸浓度等措施;
(2)滴加Na2S溶液会生成CuS沉淀,离子反应式为:Cu2++S2-![]() CuS↓;
CuS↓;
(3)a.FeOOH中铁是+3价,a错误;
b.pH=4,c(OH-)=1×10-10mol·L-1,c(Fe3+)=![]() =2.64×10-9mol·L-1,b错误。
=2.64×10-9mol·L-1,b错误。
c项符合电荷守恒、得失电子守恒等守恒关系,也符合反应的酸碱性,c正确;
d.观察图象可知d正确;
故答案选cd;
(4)滤液Ⅲ之前已将Cu、Zn、Fe除去,所以滤液中主要含有NiSO4;
(5)由于Ni2+的水溶液为绿色,所以可通过观察滤液的颜色来判断碳酸镍是否完全沉淀;若沉淀完全,上层清液为无色;
(6)将NiCO3沉淀转化为NiSO4,要先通过过滤,并用蒸馏水洗净沉淀,再向沉淀中加6 mol/L的H2SO4溶液,直至恰好完全溶解,之后蒸发浓缩、冷却结晶、过滤、洗涤、干燥。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】已知NO2和N2O4可以相互转化:2NO2(g)![]() N2O4(g) △H<0。现将一定量NO2和N2O4的混合气体通入体积为2L的恒温密闭容器中,反应物浓度随时间变化关系如图所示。
N2O4(g) △H<0。现将一定量NO2和N2O4的混合气体通入体积为2L的恒温密闭容器中,反应物浓度随时间变化关系如图所示。

(1)图中共有两条曲线X和Y,其中表示NO2浓度随时间变化的曲线是___;a、b、c、d四个点中,表示化学反应处于平衡状态的点是___。
(2)前10min内用NO2表示的化学反应速率v(NO2)=___mol·L-1·min-1。
(3)①据图分析,在25min时采取的措施是___(填序号)。
A.加入催化剂 B.缩小容器体积
C.加入一定量的NO2 D.加入一定量的N2O4
②若在35 min时,保持温度不变,快速缩小容器的体积至1L,气体的颜色变化过程是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应:A(s)+2B(g)![]() C(g)+D(g)已达平衡的是( )
C(g)+D(g)已达平衡的是( )
A. 混合气体的压强B. 混合气体密度
C. A的物质的量浓度保持不变D. 气体总物质的量保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A+a B![]() C+2 D(a为化学计量数),已知B、C、D为气态物质。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是
C+2 D(a为化学计量数),已知B、C、D为气态物质。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是

A.T2>T1,p2>p1
B.该反应为放热反应
C.若a=2,则A为液态或固态物质
D.增加B的物质的量,该反应的![]() H增大
H增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡酸钠用于制造陶瓷电容器的基体、颜料和催化剂。工业上以锡碲渣(主要含Na2SnO3和Na2TeO3)为原料,制备锡酸钠的工艺流程图如下,请回答下列问题:
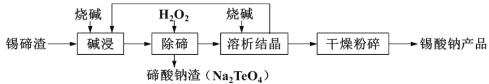
已知:锡酸钠(Na2SnO3)和亚碲酸钠(Na2TeO3)均易溶于碱。
(1)“碱浸”过程中,锡碲浸出率与溶液中游离碱质量浓度关系如图所示,则最理想的质量浓度为__________,理由是______________。

(2)如图反映的是“除碲”过程中反应温度对碲脱除率的影响关系,70℃后随温度升高碲脱除率下降的原因可能是______________。

(3)“除碲”反应的离子方程式为_________________。
(4)从“溶析结晶”回到“碱浸”的物质除烧碱外,主要还有_____________(写化学式)。
(5)“溶析结晶”母液中还含有少量SbO43-,可用锡片将Sb置换出来,锡转化成最高价含氧酸盐,写出反应的离子方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是探究铁发生腐蚀的装置图。发现开始时U形管左端红墨水水柱下降,一段时间后U形管左端红墨水水柱又上升。下列说法中不正确的是( )
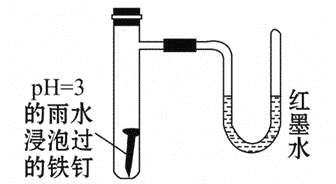
A.开始时发生的是析氢腐蚀
B.一段时间后发生的是吸氧腐蚀
C.两种腐蚀负极的电极反应式均为Fe-2e-=Fe2+
D.析氢腐蚀的总反应式为2Fe+O2+2H2O=2Fe(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一些常见有机物的转化关系,关于反应①~⑦的说法不正确的是( )
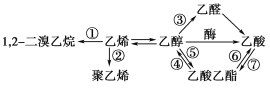
A. 只有反应③是氧化反应B. 反应①是消去反应
C. 只有反应②是加成聚合反应D. 反应④⑤⑥⑦是取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀行业产生的酸性含铬废水对环境有污染,其中所含的Cr(VI)是主要污染物,可采用多种方法处理将其除去,查阅资料可知: 常温下,部分阳离子以氢氧化物形式沉淀时溶液的 pH 如下表:
阳离子 | Fe3+ | Fe2+ | Cr3+ |
开始沉淀的 pH | 1.9 | 7.0 | 4.3 |
沉淀完全的 pH | 3.2 | 9.0 | 5.6 |
I.腐蚀电池法
(1)向酸性含铬废水中投放废铁屑和焦炭,利用原电池原理还原 Cr(VI)。下列关于铁屑的说法中正确的是______________(填字母序号)。
a.作原电池的正极 b.在反应中作还原剂 c.铁屑生成 Fe3+可以进一步还原![]()
II.电解还原法
向酸性含铬废水中加入适量NaCl固体,以Fe为电极电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准。装置如下图所示。

(2)B极连接电源的___________极;
(3)电解开始时,B 极上主要发生的电极反应为2H++2e-= H2↑,此外还有少量![]() 在B极上直接放电,该反应的电极反应式为 _______________。
在B极上直接放电,该反应的电极反应式为 _______________。
(4)①酸性环境可以促使![]() 到
到![]() 的转化,写出对应的离子方程式:__________________;
的转化,写出对应的离子方程式:__________________;
②写出酸性环境中 Fe2+还原![]() 的离子方程式_______________________。
的离子方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应![]() 达到平衡,正反应速率随时间变化的示意图如下所示。
达到平衡,正反应速率随时间变化的示意图如下所示。
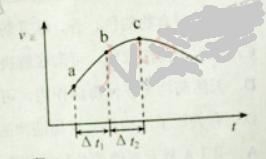
A. 反应在c 点达到平衡状态
B. 反应物浓度:![]() 点小于
点小于![]() 点
点
C. 反应物的总能量低于生成物的总能量
D. ![]() 时,SO2的转化率:
时,SO2的转化率:![]() 段小于
段小于![]() 段
段
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com