
按要求完成下列填空
(1)写出下列物质的电离方程式:
Fe2(SO4)3_____________________________________________,
NaHCO3______________________________________________;
(2)写出下列反应的离子方程式:
稀盐酸与碳酸钙反应___________________________________,
氢氧化钡溶液与稀硫酸反应_______________________________;
(1)Fe2(SO4)3=2Fe3++3SO42-,NaHCO3=Na++HCO3-
(2)CaCO3+2H+=Ca2++CO2↑+ H2O Ba2++2OH-+2H++SO42-=BaSO4↓+ 2H2O
解析试题分析:(1)表示电解质电离出离子的式子属于电离方程式,则硫酸铁与碳酸氢纳的电离方程式分别是Fe2(SO4)3=2Fe3++3SO42-、NaHCO3=Na++HCO3-。
(2)碳酸钙是难溶性物质,应该用化学式表示,则稀盐酸与碳酸钙反应的离子方程式为CaCO3+2H+=Ca2++CO2↑+ H2O;氢氧化钡溶液与稀硫酸反应生成硫酸钡白色沉淀和水,因此该反应的离子方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+ 2H2O。
考点:考查电离方程式和离子方程式的书写


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:填空题
写出下列反应的离子反应方程式(全对得10分,有错即为0分)
(1)NaAlO2溶液中加入少量的盐酸
(2)AlCl3溶液中加入过量的NaOH
(3)Al2O3与NaOH水溶液的反应
(4)Fe3O4溶解在稀盐酸中
(5)FeCl2溶液中加入酸化的H2O2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有一瓶澄清的溶液,其中可能含H+、NH4+、K+、Cu2+、Fe3+、CO32-、I-中的一种或几种,取该溶液进行如下实验:
①用pH试纸检验,表明溶液呈强酸性
②取部分溶液,加入数滴新制的氯水及少量的CCl4,振荡后CCl4层显紫色
③另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成
④将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定并回答:
(1)在溶液中,肯定存在的有 ,肯定不存在的离子有 。
(2)不能确定是否存在的离子有_______。证明它(们)是否存在的实验方法是 。
(3)写出步骤②涉及的离子方程式,并用单线桥标出电子转移的方向和数目 。
(4)写出步骤④涉及的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有以下物质:①NaCl晶体, ②液态SO3, ③液态醋酸, ④汞,⑤BaSO4固体,⑥蔗糖(C12H22O11),⑦酒精(C2H5OH),⑧熔融KNO3
请回答下列问题(填序号):
(1)以上物质中能导电的是 ;
(2)以上物质中属于电解质的是 ;
(3))以上物质中属于非电解质的是 ;
(4)以上物质中属于弱电解质的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示: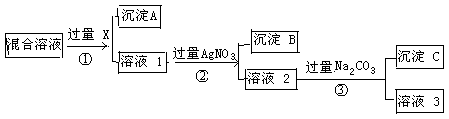
请回答下列问题:⑴写出实验流程中下列物质的化学式
试剂X : 沉淀A:
⑵上述实验流程中加入过量的Na2CO3的目的是 。
⑶按此实验方案得到的溶液3中肯定含有 (填化学式)杂质。
(4)请写出①②中反应的离子方程式①
②
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D四种可溶性盐,知其阳离子分别是Na+、Ba2+、Cu2+、Ag+ 中的某一种,
阴离子分别是Cl-、SO42-、CO32-、NO3- 中的某一种。现做以下实验:
① 将四种盐各取少量,分别溶于盛有5 mL蒸馏水的四支试管中,只有B盐溶液呈蓝色。
② 分别向4支试管中加入2 mL稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象。
(1)根据上述事实,推断这四种盐的化学式分别为:
A 、B 、C 、 D 。
(2)写出实验步骤②中涉及到的所有反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在某钠盐溶液中,除Cl-之外可能还含有等物质的量的下列阴离子中的一种或多种:SO32-、CO32-、SiO32-、I-、NO3-、SO42-。在此溶液中加入过量盐酸,产生气泡,溶液颜色变深,但仍澄清,并且原溶液中的阴离子种类减少了3种。试回答下列问题。
(1)原溶液中是否有SiO32-? (填“有”或“没有”),判断理由是 。(用离子方程式表示)
(2)生成的气体中一定有 。它具有的性质是 (填字母序号)。
| A.无色无味 |
| B.无色有刺激性气味 |
| C.属于大气污染物 |
| D.难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某溶液中可能含有Ba2+、Na+、SO42-、CO32-、HCO3-、Cl-等离子中的一种或几种。现进行以下实验:
①取上述溶液少量加入过量BaCl2溶液,产生白色沉淀,过滤,向沉淀中加入过量的硝酸,沉淀完全溶解,并产生气体;
②向实验①的滤液中滴入AgNO3溶液,出现白色沉淀;由以上实验判断,该溶液中肯定存在的离子有______________________________;
肯定不存在的离子为__________ _________;不能确定是否存在的离子________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某小组查文献得知:氧化性I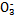 >Fe3+>I2,3Br2+6FeCl2
>Fe3+>I2,3Br2+6FeCl2 2FeBr3+4FeCl3;I2+2S2
2FeBr3+4FeCl3;I2+2S2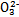
 S4
S4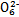 +2I-;CuI是一种白色沉淀(Ksp=1.3×1
+2I-;CuI是一种白色沉淀(Ksp=1.3×1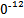 )。
)。
Ⅰ.该小组为确定一份加碘盐(可能含有KIO3、KI、Mg2+、Fe3+)的成分,设计定性实验加以猜想和验证。
(1)实验过程如下:
| 实验步骤 | 实验过程和现象 | 对应结论 | |
| 步骤1 | 取一定量碘盐,用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份 | _____________ | |
| 步 骤 2 | 第①份 试液 | 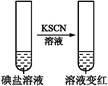 | 碘盐中肯定含 |
| 第②份 试液 | 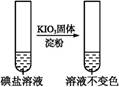 | _____________ | |
| 第③份 试液 | 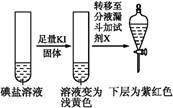 | X为 (填化学式) | |
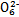 、I2、Br2的氧化性由强到弱的顺序是 。
、I2、Br2的氧化性由强到弱的顺序是 。 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com