
����Ŀ��SO2��Σ����Ϊ���صĴ�����Ⱦ��֮һ��SO2 �ĺ����Ǻ���������Ⱦ��һ����Ҫָ�ꡣ��ҵ�ϳ����ô���ԭ�������շ�����SO2������ԭSO2������������SO2��Ⱦ�����ҿɵõ��м�ֵ�ĵ���S��
��1���ڸ�����ִ��������£�CH4��ʹSO2ת��ΪS��ͬʱ����CO2 ��H2O����֪CH4��S��ȼ���ȷֱ�Ϊa kJ/mol ��b kJ/mol��CH4��SO2��Ӧ���Ȼ�ѧ����ʽΪ___________________������H�ú�a��b�Ĵ���ʽ��ʾ��
��2����H2��ԭSO2����S�ķ�Ӧ��������ɣ���ͼ1��ʾ���ù�����������ʵ����ʵ���Ũ����ʱ��ı仯��ϵ��ͼ2 ��ʾ��

�ٷ�����֪XΪ____________��д��ѧʽ����0~t1ʱ��ε��¶�Ϊ_____________��0~t1ʱ�����SO2 ��ʾ�Ļ�ѧ��Ӧ����Ϊ________________________________��
���ܷ�Ӧ�Ļ�ѧ����ʽΪ_______________________________�����ɲ�д������
��3����̿����ԭSO2����S2����ѧ����ʽΪ��2C(s)+2SO2(g)![]() S2(g)+2CO2(g)�����������У�lmol/L
S2(g)+2CO2(g)������������lmol/L
SO2�������Ľ�̿��Ӧ��SO2��ת�������¶ȵı仯��ͼ3 ��ʾ��

�ٸ÷�Ӧ�Ħ�H_______________0���������������
�ڼ���a���ƽ�ⳣ��Ϊ_______________________��
��4����ҵ�Ͽ���Na2SO3��Һ����SO2���÷�Ӧ�����ӷ���ʽΪ_______________________________��25��ʱ��1mol/L��Na2SO3��Һ����SO2������ҺpH=7ʱ����Һ�и�����Ũ�ȵĴ�С��ϵΪ______________________________��[��֪��H2SO3�ĵ��볣��K1=1.3��10-2��K2=6.2��10-8]
���𰸡� CH4 (g)+2SO2 (g)=== CO2 (g)+2S (s)+2H2O(l) ��H=��2b-a�� kJ/mol H2S 300�� 2��10-3/t1 mol/(L�� min) 2H2+SO2 === S+2H2O �� 36.45 mol/L SO32- +SO2 + H2O === 2HSO3- c(Na+)��c(HSO3-)��c(SO32-)��c(H+)=c(OH-)
����������1����֪CH4��S��ȼ���ȷֱ�Ϊ890.3kJ/mol��297.2kJ/mol������
��CH4(g)+2O2(g)==CO2(g)+2H2O(l)��H=-a kJ/mol����S(s)+O2(g)===SO2(g)��H=-bkJ/mol�����ݸ�˹���ɿ�֪�٣��ڡ�2���õ�CH4��SO2��Ӧ���Ȼ�ѧ����ʽΪ��CH4(g)+2SO2(g)==CO2(g)+2S(s)+2H2O(l)��H=��2b-a��kJ/mol����ȷ�𰸣�CH4 (g)+2SO2 (g)==CO2 (g)+2S (s)+2H2O(l) ��H=��2b-a��kJ/mol��
��2�����������������Ӧ����X��X��SO2��Ӧ����S����Ӧ��X�ǻ�ԭ������XΪH2S��0��t1ʱ�������Ҫ������X����Ӧ���¶�Ϊ300�棬0��t1ʱ��ζ�������Ũ�ȼ���0.002mol/L������SO2��ʾ�Ļ�ѧ��Ӧ����Ϊ0.002mol/L��t1min��2��10-3/t1mol/(L��min)����ȷ�𰸣� H2S�� 300�棻2��10-3/t1 mol/(L�� min)��
�ڸ���ԭ���غ��֪��Ӧ�л���ˮ���ɣ����ܷ�Ӧ�Ļ�ѧ����ʽΪ2H2+SO2![]() S+2H2O����ȷ�𰸣�2H2+SO2
S+2H2O����ȷ�𰸣�2H2+SO2![]() S+2H2O��
S+2H2O��
��3���ٴﵽƽ��������¶ȶ��������ת���ʽ��ͣ�˵��ƽ�����淴Ӧ������У��÷�Ӧ�Ħ�H��0����ȷ�𰸣��� ��
��a��SO2��ת������0.9�����Ķ���������0.9mol/L������CO2��0.9mol/L��S2(g)��0.45mol/L��ʣ��SO2��0.1mol/L����˸��¶��µ�ƽ�ⳣ��Ϊ![]() ��36.45 mol/L����ȷ�𰸣�36.45 mol/L��
��36.45 mol/L����ȷ�𰸣�36.45 mol/L��
��4����ҵ�Ͽ���Na2SO3��Һ����SO2���������������ƣ��÷�Ӧ�����ӷ���ʽΪSO32-+SO2+H2O===2HSO3-��25��ʱ��1mol/L��Na2SO3��Һ����SO2������ҺpH=7ʱ���������������ƺ����������ƵĻ����Һ������������ĵڶ������볣����֪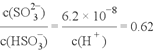 �������Һ�и�����Ũ�ȵĴ�С��ϵΪc(Na+)��c(HSO3-)��c(SO32-)��c(H+)=c(OH-)����ȷ�𰸣�SO32- +SO2+H2O == 2HSO3- ��c(Na+)��c(HSO3-)��c(SO32-)��c(H+)=c(OH-)��
�������Һ�и�����Ũ�ȵĴ�С��ϵΪc(Na+)��c(HSO3-)��c(SO32-)��c(H+)=c(OH-)����ȷ�𰸣�SO32- +SO2+H2O == 2HSO3- ��c(Na+)��c(HSO3-)��c(SO32-)��c(H+)=c(OH-)��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����373 Kʱ����0.5 mol N2O4ͨ�����Ϊ5 L�ĺ�������ܱ������У��������ֺ���ɫ���塣��Ӧ���е�2 sʱ��NO2��Ũ��Ϊ0.02 mol��L-1����60 sʱ����ϵ�ﵽƽ��״̬����ʱ�����ڵ�ѹǿΪ��ʼʱ��1.6��������˵��������ǣ� ��
A. ǰ2 s��N2O4��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ0.005 mol��L-1��s-1
B. ��2 sʱ��ϵ�ڵ�ѹǿΪ��ʼʱ��1.1��
C. ƽ��ʱ��ϵ�ں�N2O4 0.2 mol
D. ƽ��ʱ��N2O4��ת����Ϊ40%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ������í�����ڱ�¶�ڳ�ʪ�Ŀ����У��γ�һ������ˮĤ����í���ᱻ��ʴ��ʾ��ͼ���¡�����˵������ȷ����

A. �����Ľ����Ա�ͭǿ��������í������������ʴ
B. ��ˮĤ���ܽ���SO2������í����ʴ�����ʱ�С
C. ͭ���ϵķ�Ӧ��2H+ + 2e�� = H2����O2 + 4e��+ 4H+ = 2H2O
D. �ڽ�������Ϳһ����֬���ܷ�ֹ��í������ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������谷���类���ϣ��1834��ϳɣ����ж�����������ʳƷ�ӹ���ʳƷ���Ӽ��������ϣ��������֪�������谷�����У���Ԫ�صĺ����ߴ�66.67%����Ԫ�ص���������Ϊ4.76%������Ϊ̼Ԫ�ء�������Է�����������100����С��150���Իش��������⣺
��1������ʽ��ԭ�Ӹ�����N(C)��N (H)��N(N)=________________________��
��2�����˴Ź���������ʾֻ��1�����շ壬������ױ�����1����̼������Ԫ����ɵ���Ԫ�ӻ����������谷�Ľṹ��ʽΪ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����2K2CrO4+H2SO4![]() K2Cr2O7+K2SO4+H2O
K2Cr2O7+K2SO4+H2O
��K2Cr2O7+6FeSO4+7H2SO4![]() 3Fe2(SO4)3+ Cr2(SO4)3 +K2SO4+7H2O
3Fe2(SO4)3+ Cr2(SO4)3 +K2SO4+7H2O
��Fe2(SO4)3+2HI![]() 2FeSO4+I2+H2SO4
2FeSO4+I2+H2SO4
���н�����ȷ����
A. �٢ڢ۾���������ԭ��Ӧ
B. ������ǿ��˳����K2Cr2O7��Fe2(SO4)3��I2
C. ��Ӧ�����������뻹ԭ�������ʵ���֮��Ϊ6��1
D. ��Ӧ����0.1 mol��ԭ����ʧȥ������Ϊ6.02��1023
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������Ļ�ѧ��ֻ�����Ӽ�����
A. KCl B. NaOH C. HCl D. SO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�������� Cl2>Br2>Fe3+>I2�����������ӷ���ʽ��ȷ������
A. ����������FeBr2��Һ��ӦCl2+2Br-=2C1-+Br2
B. ����������FeBr2��Һ��ӦCl2+Fe2++2Br-=2Cl-+Br2+Fe3+
C. ������FeBr2��Һ�����ʵ���1��1��Ӧ2Cl2+2Fe2++2Br-=4Cl-+Br2+2Fe3+
D. ����������FeI2��Һ��ӦCl2+2Fe2+=2Cl-+2Fe3+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���۲�����ʵ��װ��ͼ����Ҫ������

��1��װ����c��d��e�����Ʒֱ�Ϊ____________��____________��____________��
��2�������������ʣ���Ҫ������װ���н��У�
��.����H2���ɲ���_______����װ����ţ�װ�á�
��. �����ˮ�еĵ�Ӧ��ѡ��װ��_____����װ����ţ�����_______��_______������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��298 Kʱ��N2��H2��Ӧ�����������仯������ͼ������������ȷ����

A. �÷�Ӧ���Ȼ�ѧ����ʽΪ��N2+3H2![]() 2NH3 ��H��-92 kJ��mol
2NH3 ��H��-92 kJ��mol
B. a�����Ǽ������ʱ�������仯����
C. ����������û�ѧ��Ӧ�ķ�Ӧ�Ȳ��ı�
D. ���¶ȡ����һ���������£�ͨ��1 mol N2��3 mol H2��Ӧ��ų�������Ϊ92kJ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com