
下列对图象描述正确的是

A.图①表示体积和pH值均相同的稀硫酸和醋酸,与足量的镁反应生成H2量的关系
B.图②表示向NaOH溶液中滴加稀盐酸,溶液导电性变化的关系
C.图③表示2SO2(g)+O2(g) 2SO3(g)反应过程中,SO2和O2反应速率大小关系
2SO3(g)反应过程中,SO2和O2反应速率大小关系
D.图④表示向氨水中滴加稀硫酸时,溶液的pH大小变化关系
科目:高中化学 来源:2014-2015重庆市高二上学期第二次月考化学试卷(解析版) 题型:实验题
氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现有0.01 mol·L-1KMnO4酸性溶液和未知浓度的无色NaHSO3溶液。反应离子方程式是2MnO4-+5HSO3-+H+ 2Mn2++5SO42-+3H2O。填空回答问题:
2Mn2++5SO42-+3H2O。填空回答问题:
(1)滴定过程中用到的玻璃仪器除了酸式滴定管、碱式滴定管外还缺少_____________________
(2)不用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因:
(3)选何种指示剂,说明理由 ,到达终点时颜色变化
(4)当用酸滴定碱时,下列操作使测定结果(碱的浓度)偏高的是
① 酸式滴定管滴至终点,俯视读数
② 碱液移入锥形瓶后,加入10mL蒸馏水
③ 酸式滴定管注入酸溶液后,尖嘴有气泡时便开始滴定,滴定后无气泡
④ 酸式滴定管用蒸馏水润洗后,未用标准液润洗
(5)有关数据记录如下:
实验序号 | 待测液体积(mL) | 所消耗KMnO4酸性溶液的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.50 | 20.60 |
2 | 20.00 | 6.00 | 25.90 |
3 | 20.00 | 1.40 | 24.20 |
则NaHSO3溶液的物质的量浓度为______________mol/L。
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省濮阳市高二上学期第三次月考化学试卷(解析版) 题型:选择题
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是
A.由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O
C.由Fe、Cu、NaCl溶液组成原电池,其负极反应式为:Cu - 2e-= Cu2+
D.由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出1 mol Ag时,消耗Cu电极32g
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省弥勒市高三市统测一模理综化学试卷(解析版) 题型:选择题
有一种瓦斯分析仪能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述正确的是

A.电极a的反应式为:CH4+4O2--8e-=CO2+2H2O
B.电极b是正极,O2-由电极a流向电极b
C.瓦斯分析仪工作时,电池内电路中电子由电极a流向电极b
D.当固体电解质中有1 mol O2-通过时,电子转移4 mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省丹东五校协作体高三上学期期末考试理综化学试卷(解析版) 题型:填空题
(14分)钠和钾是活泼的碱金属元素,钠和钾及其化合物在生产和生活中有广泛应用。
(1)将0.0lmol下列物质①Na2O2 ②Na2O ③Na2CO3 ④NaCl分别加入100mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计) ;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时其负极的电极反应式是__ __;
(3)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。请写出其反应的化学方程式__ __;
(4)现有一Na2CO3和NaHCO3的混合物样品,取ag该混合物充分加热,减重bg则该混合物样品中Na2CO3的质量分数是 ;
(5)钠一钾合金可在核反应堆中用作热交换液。5.05g钠一钾合金溶于200mL水生成0.075mol氢气。则该溶液中氢氧根离子的物质的量浓度是 ;(忽略溶液体积变化)。计算并确定该钠一钾合金的化学式为 (列出计算过程)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省丹东五校协作体高三上学期期末考试理综化学试卷(解析版) 题型:选择题
化学与科学、技术、社会、环境密切相关,下列有关说法正确的是
A.锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,再用酸除去
B.日本福岛核电站爆炸时释放的两种放射性核素13153I与13755Cs的中子数相等
C.铝合金的大量使用归功于人们能使用焦炭等还原剂从氧化铝中获得铝
D.海水淡化可以解决淡水供应危机,向海水中加入明矾可以使海水淡化
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省镇江市高三第一学期期末调研测试化学试卷(解析版) 题型:填空题
(12分)过碳酸钠(2Na2CO3·3H2O2)俗称固体双氧水,是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的制备流程如下:
(注:BC-1、BC-2均为稳定剂,其中BC-1是由异丙醇和三乙醇胺按一定比例混合而成)
(1)结晶过程中加入氯化钠、搅拌,作用是 。
(2)加入BC-2稳定剂与工业纯碱中含有的Fe3+ 杂质生成稳定的配合物的目的是 。
(3)洗涤抽滤产品,应选用合适的洗涤试剂是 (填写序号)。
A.饱和氯化钠溶液 B.水 C.异丙醇 D.碳酸钠饱和溶液
(4)工业上常以活性氧的质量分数[ω(活性氧)=16 n(H2O2) / m(样品) ×100﹪]来衡量过碳酸钠产品的优劣,ω≥13﹪为优等品。现将0.2000g某厂家生产的过碳酸钠样品(所含杂质不参与后面的反应)溶于水配成溶液,加入适量稀硫酸酸化,再加入足量KI,摇匀后静置于暗处,充分反应后加入少量淀粉试剂,用0.1000mol/LNa2S2O3溶液滴定到终点,消耗Na2S2O3溶液33.00mL。(已知:2Na2S2O3+I2=Na2S4O6+2NaI),通过计算判断样品是否为优等品(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省郴州市高三第二次月考理综化学试卷(解析版) 题型:实验题
(15分)实验室用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示(加热及夹持装置省略):
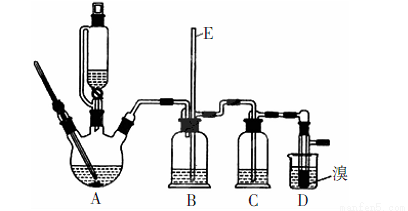
制备1,2--溴乙烷可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。有关数据列表如下:

回答下列问题:
(1)装置A、D中发生主要反应的化学方程式为: ; 。
(2)装置B中长玻璃管E的作用: 。
(3)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 ;(填正确选项前的字母)
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(4)在装置C中应加入____,其目的是完全吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸
c.氢氧化钠溶液 d.酸性KMnO4溶液
(5)反应过程中应用冷水冷却装置D.其主要目的是: ;但又不能过度:冷却(如用冰水),其原因是: ;将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com