
����Ŀ����������ƣ�Na2S2O3��5H2O�����������մ��ֳ�Ϊ������������������ˮ���������Ҵ������ȡ�������ֽ⡣ijʵ����ģ�ҵ���ȡ��������ƣ��䷴Ӧװ�ü������Լ�����ͼ��

ʵ������������Ϊ��
�ٿ�����Һ©����ʹ�����������£��ʵ����ڷ�Һ�ĵ��٣�ʹ��Ӧ������SO2����Ͼ��ȵ�ͨ��Na2S��Na2CO3�Ļ����Һ�У�ͬʱ�����綯������������ˮԡ���ȣ��С�
��ֱ�������Ļ��Dz�����ʧ����������Һ��pH�ӽ�7ʱ��ֹͣͨ��SO2���塣
����
��1�������A������_______��
��2��Ϊ�˱�֤��������ƵIJ�����ʵ���в�������ҺpH <7���������ӷ���ʽ����ԭ��_________��
��3��д��������ƿB����ȡNa2S2O3����Ӧ���ܻ�ѧ��Ӧ����ʽ________��
��4����������������Һ�л�ýϸ߲���Na2S2O3��5H2O�IJ���Ϊ

Ϊ���ٲ�Ʒ����ʧ��������Ϊ���ȹ��ˣ�����������ԭ����______����������______���������dz��ˡ�ϴ�ӡ����
��5���ⶨ��Ʒ����
ȡ6.00g��Ʒ�����Ƴ�100mL��Һ��ȡ10.00mL��Һ���Ե�����ҺΪָʾ������Ũ��Ϊ0.500mol/LI2�ı���Һ���еζ�����Ӧԭ��Ϊ2S2O32-+I2=S4O62-+2I-��������ݼ�¼���±���ʾ��
��� | 1 | 2 | 3 |
��Һ�����/mL | 10.00 | 10.00 | 10.00 |
����I2����Һ�����/mL | 19.98 | 22.50 | 20.02 |
�ζ�ʱ���ﵽ�ζ��յ��������___________����Ʒ�Ĵ���Ϊ____________��
��6��Na2S2O3������������������Һ���ױ�Cl2������SO42-���÷�Ӧ�����ӷ���ʽΪ_________��
���𰸡� ������ƿ S2O32-+2H+=S��+SO2��+H2O 4SO2+2Na2S+Na2CO3=CO2+3Na2S2O3 Ϊ�˷�ֹ������©���д����������²��ʽ��� ����Ũ������ȴ�ᾧ ��Һ����ɫ����ɫ���Ұ���Ӳ���ɫ 82.67% S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+
����������1������A������������ƿ����2�����������Ϣ����������ƣ�Na2S2O3��5H2O����������Һ�в����ȶ����ڣ�������Ӧ�����ӷ���ʽΪS2O32-+ 2H+ == S��+ SO2��+H2O������ʵ���в�������ҺpH <7����3�����������Ϣ������ƿ�м�����Na2S��Na2CO3��Һ��ͨ����SO2���Ʊ�Na2S2O3��Na2S ����Ԫ����-2��ʧ��������Na2S2O3��SO2��SԪ����+4�۵õ�������Na2S2O3�����ݻ��ϼ�������ȡ�ԭ���غ���ƽ���ܷ�Ӧ�Ļ�ѧ����ʽΪ4SO2+2Na2S+Na2CO3 =CO2+3Na2S2O3����4�������¶��ܽ���������Ϊ���ٲ�Ʒ����ʧ��������Ϊ���ȹ��˵�ԭ����Ϊ�˷�ֹ������©���д����������²��ʽ��ͣ��������ǵõ����壬���ʵ�����������Ũ������ȴ�ᾧ����5��������������ɫ����ﵽ�ζ��յ����������Һ����ɫ����ɫ���Ұ���Ӳ���ɫ�����ݱ������ݿ�֪�ڶ���ʵ�����̫����ȥ�����ı�Һ���ƽ��ֵ��20.00mL�����ĵ�����ʵ�����0.0500mol/L��0.02L=0.001mol��������������Ƶ����ʵ�����0.002mol��������0.002mol��248g/mol��0.486g�����Ʒ�Ĵ���Ϊ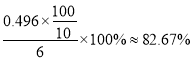 ����6��������Ŀ��Ϣ��֪��Na2S2O3����ˮ������Ӧ����Na2SO4��H2SO4����������ԭΪHCl����Ӧ�����ӷ���ʽΪS2O32��+ 4Cl2 + 5H2O��2SO42��+ 8Cl��+ 10H+ ��
����6��������Ŀ��Ϣ��֪��Na2S2O3����ˮ������Ӧ����Na2SO4��H2SO4����������ԭΪHCl����Ӧ�����ӷ���ʽΪS2O32��+ 4Cl2 + 5H2O��2SO42��+ 8Cl��+ 10H+ ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ����������ԭ��Ӧ���� �� ��
A. H2SO4+2NaOH=Na2SO4+2H2O B. CuO+H2![]() Cu+ H2O
Cu+ H2O
C. NH3+HCl=NH4Cl D. 2NaHCO3![]() Na2CO3+ H2O +CO2��
Na2CO3+ H2O +CO2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ԭ��Ӧ��˵������ȷ���ǣ� ��
A. ����ʧȥ�ĵ�����Խ�࣬�仹ԭ��Խǿ
B. ��������Ԫ�ػ��ϼ����ߵķ�Ӧ�л�ԭ��Ӧ
C. ijԪ���ɻ���̬��Ϊ����̬������һ������ԭ
D. �û���Ӧһ������������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣�����ÿ��������Ŵ���һ�ֶ�����Ԫ�ء�

�ش��������⣺
��l��д���ڵ�Ԫ������_______��
��2��Ԫ�آ��⻯��Ļ�ѧʽ��_______��
��3���������ں͢�����Ԫ����Ƚϣ��ǽ�������ǿ����_______����Ԫ�ط��ţ���
��4��Ԫ�آܺ�Ԫ�آݵ�����������Ӧ��ˮ��������Һ�����Ӧ�����ӷ���ʽ��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(CnH2n+2)��ϩ��(CnH2n)����ϩ��(CnH2n--2)��ͨʽ�������ó�̼��ԭ�ӵĸ��������������˫����һ����ϵ��ij�����ķ���ʽΪCxHy����������˫����Ŀ���Ϊ
A��y/2 B��(y��x)/2 C��(y��2��x)/2 D��(2x��2��y)/2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ýӴ�����5t98%��Ũ���ᣬ����������Ҫ��FeS2 75%�����ʲ�����Ԫ�أ���������Ϊ �� ��
A. 4.3t B. 8t C. 4t D. 5.6t
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ü�������������ȡ����Ӧ��ȡ����Ʒ����������ڹ�ҵ���ѳ�Ϊ��ʵ��ij��ѧ��ȤС��ͨ����ʵ������ģ���������̣�����Ƶ�ģ��װ�����£�

�������Ҫ��ش�
��1��Bװ�������ֹ��ܣ������Ȼ�����壻��_____________��_____________��
��2����V(Cl2)/V(CH4)��x��������������������Ȼ��⣬��xֵӦ_____________��
��3��Eװ�ó����������⣬�������л����E�з�����л������ѷ���Ϊ________����װ�û���ȱ�ݣ�ԭ����û�н���β����������β����Ҫ�ɷ�Ϊ________(����)��
a��CH4�� b��CH3Cl�� c��CH2Cl2�� d��CHCl3�� e��CCl4
��4��Dװ�õ�ʯ���о��Ȼ���KI��ĩ����������___________________��
��5��Eװ�õ�������___________________(����)��
A���ռ����� B���������� C����ֹ���� D�������Ȼ���
��6����Cװ���У�����һ��ʱ���ǿ�����䣬����Ӳ�ʲ������ڱ��к�ɫС����������д���û�����ɫС�����Ļ�ѧ����ʽ_____________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����()
A. 2015��8��12�գ�����������ij��˾�IJֿⷢ����ը���·��ֿ������˴���������李��軯�ơ���ʯ�ͽ����Ƶ�Σ�ջ�ѧƷ������ҩƷ�����ڵ����
B. ��ά�ء����ǡ������Ǻ�֬����һ�������¶��ɷ���ˮ�ⷴӦ
C. ��������Ի����кܴ�Σ�������ƻ������㣬�γ����꣬�����⻯ѧ������
D. ��ҵ���������������ʯ��ˮ��Ӧ��ȡƯ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����12�֣�������D�ǹ����ȶ�������ϳ�·������ͼ

��1��B�ķ���ʽΪ �� C�й��������� ��
��2��C��D�ķ�Ӧ����Ϊ ��
��3��B��C�Ļ�ѧ����ʽΪ ��
��4��������D���ܾ��е������� ��ѡ����ţ���
a���ӳɷ�Ӧ b����FeCl3��Һ������ɫ��Ӧ
c����ȥ��Ӧ d��������Ӧ
��5��������B��3����Ӧ���Ʊ� ����Ӧ���������� ��ѡ����ţ���
����Ӧ���������� ��ѡ����ţ���
a���ӳ� �� ȡ���� ��ȥ
b��ȡ������ȥ���ӳ�
c����ȥ���ӳɡ�ȡ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com