
【题目】有A、B两种烃,A常用作橡胶、涂料、清漆的溶剂,胶粘剂的稀释剂、油脂萃取剂。取0.1molA在足量的氧气中完全燃烧,生成13.44LCO2气体(标准状况下测定),生成的H2O与CO2的物质的量之比为1:1。则:
(1)A的分子式为___________________________。
(2)A的同分异构体较多。其中:①主链有五个碳原子;②能使溴的四氯化碳溶液和高锰酸钾酸性溶液褪色;③在Ni催化下能与氢气发生加成反应。符合上述条件的同分异构体有:![]() 、
、
![]() 、
、![]() 、
、![]() 、___________________、_____________________ (写结构简式,不考虑顺反异构)。
、___________________、_____________________ (写结构简式,不考虑顺反异构)。
写出用![]() 在一定条件下制备高聚物的反应方程式_____________________,反应类型为____________________。
在一定条件下制备高聚物的反应方程式_____________________,反应类型为____________________。
(3)B与A分子中磯原子数相同,1866年凯库勒提出B分子为单、双键交替的平面结构,解释了B的部分性质,但还有一些问题尚未解决,它不能解释下列事实中的______________。
a.B不能使溴水褪色 b.B能与发生加成反应
c.B的一溴代物没有同分异构体 d.B的邻位二溴代物只有一种
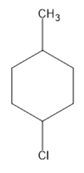
(4)M是B的同系物,0.1molM在足量的氧气中完全燃烧,产生标准状况下15.68L二氧化碳。
①写出下列反应的化学方程式:
M光照条件下与Cl2反应:______________________________。
M与浓硝酸和浓硫酸的混合酸加热:_____________________________________。
②M________(填“能”或“不能”)使高锰酸钾酸性溶液褪色,M与氢气加成产物的一氯代物有____种。
【答案】 C6H12 ![]()
![]()
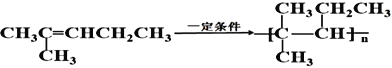 加聚反应 a、d
加聚反应 a、d 
 能 5
能 5
【解析】根据题意:0.1molA在足量的氧气中完全燃烧,生成13.44LCO2气体(0.6mol),生成的H2O的物质的量也是0.6mol,故其分子式为:C6H12;
(1)A的分子式为C6H12;
(2)A的不饱和度为1,①主链有五个碳原子;②能使溴的四氯化碳溶液和高锰酸钾酸性溶液褪色;③在Ni催化下能与氢气发生加成反应。符合上述条件的同分异构体还有:![]() 、
、![]() ;
;
用![]() 在一定条件下制备高聚物的反应方程式为:
在一定条件下制备高聚物的反应方程式为: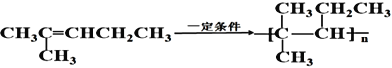 ,该反应的类型是加聚反应;
,该反应的类型是加聚反应;
(3)根据题意,B的化学式是C6H6,是苯,故苯的凯库勒式不能解释其不能使溴水褪色,由于他未提出苯是平面正六边形结构,故也解释不了其邻位二溴代物只有一种;故选ad;
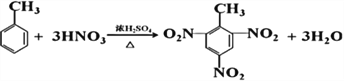
(4)0.1molM在足量的氧气中完全燃烧,产生标准状况下15.68L二氧化碳,0.7mol,故M为甲苯。①甲苯在光照条件下与Cl2反应的方程式是: ;
;
甲苯与浓硝酸和浓硫酸的混合酸加热的方程式是: ;
;
②甲苯可以使酸性高锰酸钾溶液褪色,甲苯与氢气加成产物为 其一氯代物有
其一氯代物有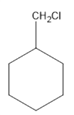 、
、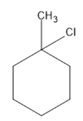 、
、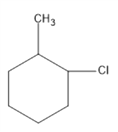 、
、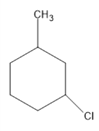 、
、 共5种。
共5种。


科目:高中化学 来源: 题型:
【题目】有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。请完成下列问题:
(1)M元素的简单离子的结构示意图为_______。
(2)Z在周期表中的位置为_____,其非金属性比W的非金属性____(填“强”或“弱”)。
(3)X、Z、W的原子半径由大到小顺序为_____________(填元素符号)。
(4)Y的氢化物化学式为______,该氢化物中化学键类型为________________(填“离子键”、“极性共价键”或“非极性共价键”)。
(5)W的单质与X的最高价氧化物的水化物反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)下列原子: ![]() C、147N、
C、147N、 ![]() Na、
Na、 ![]() H、
H、 ![]() U、
U、 ![]() K、
K、 ![]() U中共有种元素,种核素,和互为同位素.
U中共有种元素,种核素,和互为同位素.
(2)下列曲线分别表示元素的某种性质与核电荷数的关系(X为核电荷数,Y为元素的 有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中: 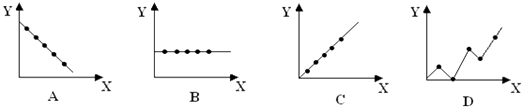
② 第ⅡA族元素的最外层电子数;
②第三周期元素的最高化合价;
③碱金属单质的熔点
(3)阴离子的中子数为N:AXn﹣共有x个电子,则N= .
(4)有下列物质中NH3、Na2O、CO2、CaCl2、CCl4、N2、NaHCO3、NaOH、Na2O2、NH4Cl属于电解质的有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验. 
(1)实验过程中铜网出现黑色和红色交替的现象. ①红色变成黑色的反应是:2Cu+O22CuO;
②黑色变为红色的化学方程式为: .
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是反应.
(2)甲和乙两个水浴作用不相同.甲的作用是;乙的作用是 .
(3)反应进行一段时间后,试管a中能收集到多种物质,它们是 . (任写两种即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是( )
A.Na+、Fe3+、NO3﹣、Cl2都可在该物质的溶液中大量共存
B.向0.1mo1/L该物质的溶液中清加0.1mo1/LNaOH溶液,生成沉淀的物质的量与逐滴加入NaOH溶液体积关系如图所示
C.检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色
D.向该物质的溶液中摘加Ba(OH)2溶液,恰好使SO42﹣完全沉淀的离子方程式为:Fe2++2SO42﹣+3Ba2++2OH﹣═2BaSO4↓+Fe(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A.将1 mol Cl2通入到水中,则N(HClO)+N(Cl﹣)+N(ClO﹣)=2NA
B.常温常压下,3.0 g含甲醛的冰醋酸中含有的原子总数为0.4NA
C.标准状况下,2.24 L的CCl4中含有的C﹣Cl键数为0.4NA
D.将CO2通过Na2O2使其增重a克时,反应中转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
下列说法不正确的是

A. 固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B. X可以是空气,且需过量
C. 捕获剂所捕获的气体主要是CO
D. 处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2-==N2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5L 1mol/L的FeCl3溶液与0.2L 1 mol/L的KCl溶液中,Cl-浓度之比为( )
A. 15∶2 B. 1∶1 C. 3∶1 D. 1∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com