
 (1)分子式为C4H10O的醇共有
(1)分子式为C4H10O的醇共有

科目:高中化学 来源: 题型:
 常温时向20mL 0.1mol?L-1 HA溶液中不断滴入0.1mol?L-1 NaOH溶液,pH变化如图.下列叙述正确的是( )
常温时向20mL 0.1mol?L-1 HA溶液中不断滴入0.1mol?L-1 NaOH溶液,pH变化如图.下列叙述正确的是( )| A、HA的电离方程式:HA═H++A- |
| B、水的电离程度:a点>b点 |
| C、c点溶液:c(H+)+c(Na+)═c(A-)+c(HA) |
| D、d点溶液:c(Na+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
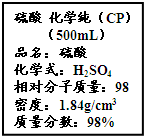 按要求完成下列小题.
按要求完成下列小题.查看答案和解析>>
科目:高中化学 来源: 题型:

| n(SO3) |
| n(SO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
ⅠA | ⅡB | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 二 | ① | ② | ③ | ||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | |||
| 四 | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com