
| 族 周期 |
ⅠA | ⅡB | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 二 | ① | ② | ③ | ||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | |||
| 四 | ⑧ |
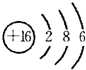 ;⑦的离子核外有3个电子层、最外层有8个电子,其离子结构示意图为
;⑦的离子核外有3个电子层、最外层有8个电子,其离子结构示意图为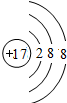 ,
, ;
; ;
;

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
| A、原子半径:C>D>B>A |
| B、A、D、E最高价氧化物对应水化物酸性增强 |
| C、只含B元素的物质一定是纯净物 |
| D、化合物C2AB3的水溶液显碱性,可用于洗去铜片表面的油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)分子式为C4H10O的醇共有
(1)分子式为C4H10O的醇共有查看答案和解析>>
科目:高中化学 来源: 题型:
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |

| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同时增大,都向左移动 |
| B、同时减小,都向右移动 |
| C、同时增大,反应I向右移动,反应II向左移动 |
| D、同时增大,反应I向左移动,反应II向右移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com