
【题目】下列有关电解质溶液的说法正确的是![]()
![]()
A. 向![]() 溶液中加入少量水,溶液中
溶液中加入少量水,溶液中![]() 减小
减小
B. 将![]() 溶液从
溶液从![]() 升温至
升温至![]() ,溶液中
,溶液中![]() 增大
增大
C. 向盐酸中加入氨水至中性,溶液中![]()
D. 向AgCl、AgBr的饱和溶液中加入少量![]() ,溶液中
,溶液中![]() 不变
不变
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y的摩尔质量相同,Y为淡黄色固体,N常温下是液体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )

A. 相对分子质量M>N,沸点M>N
B. 原子半径:D>B>C>A
C. Z 为 NaOH
D. M中含有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC﹣COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华.为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为________;
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去;①说明乙二酸具有______(填“氧化性”、“还原性”或“酸性”);②请配平该反应的离子方程式:_____MnO4-+____H2C2O4+___H+=___Mn2++____CO2↑+_____H2O
(3)将一定量的乙二酸放于试管中,按如图所示装置进行实验(夹持装置未标出):

实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红。据此回答:
①上述装置中,D的作用是_________,
②乙二酸分解的化学方程式为 ________;
(4)该小组同学将2.52g草酸晶体(H2C2O42H2O)加入到100mL 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是_______(用文字简单表述),该溶液中各离子的浓度由大到小的顺序为:_______(用离子符号表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将O2、CH4、Na2O2置于密闭容器中,在250℃下用电火花引发化学反应。反应停止后使容器内恢复至250℃,容器内的气压为零。由此得出的结论正确的是( )
A. 原O2、CH4、Na2O2物质的量之比为1∶2∶6,反应后容器内生成的固体是Na2CO3和NaHCO3
B. 原O2、CH4、Na2O2物质的量之比为2∶1∶4,反应后容器内生成的固体是Na2CO3和NaOH
C. 原O2、CH4、Na2O2物质的量之比为1∶2∶6,反应后容器内生成的固体是Na2CO3和NaOH
D. 原O2、CH4、Na2O2物质的量之比为2∶1∶4,反应后容器内生成的固体是NaHCO3和NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素及其化合物的应用广泛,回答下列问题:
(1)碘盐中含有KIO3,KIO3中碘元素的化合价是____________。
(2)84消毒液的有效成分是____________(填“NaCl”或“NaClO”)。
(3)高温下Fe2O3与CO反应是工业上炼铁的原理,该原理的化学反应方程式为____________,反应中Fe2O3做________(填“氧化剂”或“还原剂”)。
(4)实验室用NaOH溶液吸收含SO2的尾气,该反应的离子方程式为____________,SO2属于____________(填“酸性氧化物”或“碱性氧化物”),SO2能使品红溶液褪色,说明SO2具有的性质是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙、丙、丁四个装置,下列说法不正确的是
A.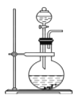 装置甲可作为制取NO2的发生装置
装置甲可作为制取NO2的发生装置
B. 装置乙可作为制取NO的收集装置
装置乙可作为制取NO的收集装置
C.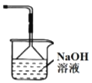 装置丙可作为制取Cl2的尾气吸收装置
装置丙可作为制取Cl2的尾气吸收装置
D. 装置丁可用于除去NH3中H2O
装置丁可用于除去NH3中H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,
时,![]() 及其钠盐的溶液中,H2SO3、HSO3-、SO32-的物质的量分数(α)随溶液pH变化关系如图所示,下列叙述错误的是( )
及其钠盐的溶液中,H2SO3、HSO3-、SO32-的物质的量分数(α)随溶液pH变化关系如图所示,下列叙述错误的是( )

A. 溶液的pH=5时,硫元素的主要存在形式为![]()
B. 当溶液恰好呈中性时: c(Na+)>c(HSO3-)+c(SO32-)
C. 向pH=8的上述溶液中滴加少量澄清石灰水, 的值增大
的值增大
D. 向pH=3的上述溶液中滴加少量稀硫酸,![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A. 钢铁发生吸氧腐蚀时,铁做负极被氧化 Fe-2e- = Fe2+
B. Na2CO3 溶液显碱性 CO32-+2H2O ![]() H2CO3 + 2OH-
H2CO3 + 2OH-
C. 氯气通入NaOH溶液得到漂白液 Cl2 + 2OH- = Cl- + ClO- + H2O
D. 向Mg(OH)2悬浊液中滴加FeCl3溶液,生成Fe(OH)3 :3Mg(OH)2 + 2Fe3+ = 2Fe(OH)3↓+3Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图装置进行实验,试回答下列问题:

(1)若开始时开关K与a连接,则A极的电极反应式为____________________B极的Fe发生__________ 腐蚀(填“析氢”或“吸氧”)
(2)若开始时开关K与b连接,下列说法正确的是________(填序号)
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
且此时装置内总反应的离子方程式为_____________________________________________________
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。

①该电解槽的阳极反应式为_________________________________________,此时通过阴离子交换膜的离子数________(填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口________(填“A”“B”“C”或“D”)导出。
用惰性电极电解体积为1L的CuSO4溶液,当阴阳极都产生3.36L(标况)气体时,请问硫酸铜的浓度为______,若要此溶液恢复到原状态需要加入________(填选项)
A.CuSO4 B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com