
| A、③⑤⑦⑧ | B、⑥⑦⑧ |
| C、③⑤⑧ | D、③④⑤⑥⑦⑧ |


科目:高中化学 来源: 题型:

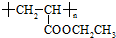 可用于制备涂料,其单体结构简式为
可用于制备涂料,其单体结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | D | E |
| 性质 结构 信息 | 单质及其盐的焰色反应为紫色(透过蓝色钻玻璃观察) | 工业上用量最大的金属,在潮湿空气中易锈蚀,生成红棕色粉末状物质. | 单质遇淀粉溶液变蓝色. | 单质为双原子分子,常温下是液态,易溶于有机溶剂. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X2Y |
| B、XY2 |
| C、XY3 |
| D、XY |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放入氧气中燃烧,检验燃烧产物都是CO2和H2O |
| B、放入银氨溶液中微热,都不发生银镜反应 |
| C、加入浓硫酸后微热,都脱水而变黑 |
| D、分别放入稀酸后煮沸几分钟,用NaOH溶液中和反应后的溶液,再加入新制的Cu(OH)2悬浊液共热,都生成红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
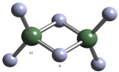 科技日报2007年1月30日讯:美、德科学家日前成功合成出具有独特化学特性的氢铝化合物(AlH3)n,其结构类似由硼和氢组成的硼烷,有关研究报告发表在最新出版的美国《科学》杂志上.最简单的氢铝化合物为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法肯定不正确的是( )
科技日报2007年1月30日讯:美、德科学家日前成功合成出具有独特化学特性的氢铝化合物(AlH3)n,其结构类似由硼和氢组成的硼烷,有关研究报告发表在最新出版的美国《科学》杂志上.最简单的氢铝化合物为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法肯定不正确的是( )| A、Al2H6中H为+1价,Al为-3价 |
| B、Al2H6在空气中完全燃烧,产物为氧化铝和水 |
| C、Al2H6分子是非极性分子 |
| D、氢铝化合物可能成为未来的储氢材料和火箭燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不同物质的量浓度硫酸等体积混合后,溶液物质的量浓度变为原来和的一半 |
| B、5.6 g铁与足量稀硫酸反应失去的电子的物质的量为0.3 mol |
| C、标准状况下,11.2L NO2气体中含氧原子数等于18 g水中含有的氧原子数 |
| D、20 g NaOH溶于1 L水,所得溶液中c(Na+)=0.5 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去N2中的少量O2:通过灼热的Cu粉,收集气体 |
| B、铅蓄电池在放电时,Pb作为负极,不断转化为PbSO4 |
| C、用盐酸酸化KMnO4溶液可以增强其氧化性 |
| D、强电解质在水中溶解度不一定大于弱电解质在水中的溶解度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com