
【题目】合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)尿素[CO(NH2)2]是一种高效化肥,其分子中各原子的原子半径大小关系为______,碳原子核外有___种运动状态不同的电子。
(2)氰化钠(NaCN)中,N元素显-3价,则非金属性N___________C(填“<”、“=”或“>”),写出氰化钠的电子式_______________。
(3)氰化钠属于剧毒物质,可用双氧水或硫代硫酸钠处理。
(a)用双氧水处理,发生的反应为:NaCN+H2O2+H2O→A+NH3↑,则A的化学式为___。
(b)NaCN与Na2S2O3二者等物质的量反应可得到两种含硫元素的离子,其中一种遇到Fe3+显血红色。写出该反应的离子方程式____________。
(4)NO2会污染环境,可用Na2CO3溶液吸收NO2并放出CO2。已知9.2 g NO2和Na2CO3溶液完全反应时转移电子0.1 mol,此反应的离子方程式是______;恰好反应后,所得溶液呈弱碱性,则溶液中各离子浓度大小关系是__________。
【答案】C > N> O > H 6 > ![]() NaHCO3 S2O32-+CN-→SCN-+SO32- 2NO2 + CO32- → CO2 + NO2-+NO3- c(Na+)> c(NO3-)> c(NO2-)> c(OH-)> c(H+)
NaHCO3 S2O32-+CN-→SCN-+SO32- 2NO2 + CO32- → CO2 + NO2-+NO3- c(Na+)> c(NO3-)> c(NO2-)> c(OH-)> c(H+)
【解析】
(1)根据元素周期律及核外电子运动状态分析解答;
(2)根据化合物中元素的化合价比较非金属性强弱,根据成键情况书写电子式;
(3)根据题给信息及元素守恒书写相关反应方程式;
(4)根据氧化还原反应原理及水解原理分析解答。
(1)CO(NH2)2分子中含有C、N、O、H四种元素,电子层数分别为2、2、2、1,所以H原子半径最小,C、N、O属于同周期,同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径C>N>O>H,碳原子核外有6个电子,所以有6种不同运动状态的电子,故答案为:C>N>O>H;6;
(2)CN-中N元素显-3价,C元素显+2价,说明N非金属性强,NaCN为离子化合物,电子式为:![]() ,故答案为:>:
,故答案为:>:![]() ;
;
(3)(a)由反应NaCN+H2O2+H2O=A+NH3↑,根据质量守恒定律可知,元素守恒、原子守恒,则A的化学式为NaHCO3,故答案为:NaHCO3;
(b)氰化钠中毒,可用Na2S2O3缓解,二者反应得到两种含硫元素的离子,其中一种遇到Fe3+可变为血红色,即反应生成SCN-、SO32-,离子方程式为S2O32-+CN-=SCN-+SO32-,故答案为:S2O32-+CN-=SCN-+SO32-;
(4)9.2gNO2的物质的量为![]() ,每0.2molNO2和Na2CO3溶液反应时转移电子0.1mol,则N的化合价分别由+4价变化为+5价和+3价,在碱性溶液中应生成NO3-和NO2-,反应的离子方程式为:2NO2 + CO32- =CO2 + NO2-+NO3-,若生成的CO2完全逸出,NO2-水解溶液呈碱性,则所得溶液中的离子浓度大小关系为:c(Na+)> c(NO3-)> c(NO2-)> c(OH-)> c(H+),故答案为:2NO2 + CO32-= CO2 + NO2-+NO3-;c(Na+)> c(NO3-)> c(NO2-)> c(OH-)> c(H+)。
,每0.2molNO2和Na2CO3溶液反应时转移电子0.1mol,则N的化合价分别由+4价变化为+5价和+3价,在碱性溶液中应生成NO3-和NO2-,反应的离子方程式为:2NO2 + CO32- =CO2 + NO2-+NO3-,若生成的CO2完全逸出,NO2-水解溶液呈碱性,则所得溶液中的离子浓度大小关系为:c(Na+)> c(NO3-)> c(NO2-)> c(OH-)> c(H+),故答案为:2NO2 + CO32-= CO2 + NO2-+NO3-;c(Na+)> c(NO3-)> c(NO2-)> c(OH-)> c(H+)。


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】二氧化钛广泛应用于各类结构表面涂料、纸张涂层等,二氧化钛还可作为制备钛单质的原料。现在工业由以下两种方法制备二氧化钛:
方法1:可用含有Fe2O3、SiO2的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要工艺流程如下:
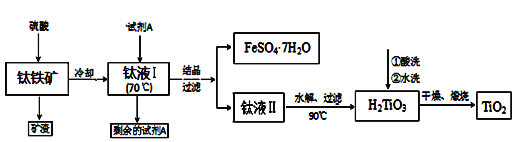
已知有关反应包括:
酸溶FeTiO3(s)+2H2SO4(aq)→FeSO4(aq)+TiOSO4(aq)+2H2O(l)
水解TiOSO4(aq)+2H2O(l)→H2TiO3(s)+H2SO4(aq)
(1)试剂A为____,钛液Ⅰ需冷却至70℃左右,若温度过高会导致产品收率降低,原因____;
(2)取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现红色,说明H2TiO3中存在的杂质离子是__________。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2会略发黄,发黄的杂质是_____________(填化学式)。
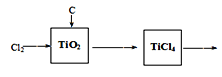
方法2:
Ⅰ.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应制得混有SiCl4杂质的TiCl4;
II.将SiCl4分离,得到纯净的TiCl4;
III.在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O,洗涤和干燥;
IV.TiO2·xH2O高温分解得到TiO2。
(1)TiCl4水解生成TiO2x H2O的化学方程式为____________________;
(2)检验TiO2x H2O中Cl-是否被除净的方法是____________________;金属钛被称为“21世纪金属”,工业制备金属钛是在800~900℃及惰性气体的保护下,在密闭反应器中,将TiCl4以一定的流速通入熔化的镁即可。主要涉及以下反应:
①TiO2+2Cl2+C→TiCl4+CO2
②TiCl4+2Mg → 2MgCl2+Ti
(3)下列推断不合理的是________
A.钛在高温下可能易与氧气反应
B.镁的熔点比钛的熔点高
C.钛的金属活动性比镁的金属活动性强
D.反应②产生的MgCl2可作为电解法制取镁的原料
(4)请完成以TiO2、Cl2和焦炭为原料制取金属Ti和Mg的流程图,并用箭头标明物料循环。___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:

(1)b极上的电极反应式为__,甲电池的总反应化学方程式是__。
(2)在粗铜的电解过程中,图中c电极的材料是__(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为__;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是__,电解一段时间后,电解液中的金属离子有__。
(3)如果要在铁制品上镀镍(二价金属,相对原子质量59),则f电极的材料是__(填“铁制品”或“镍块”,下同),e电极的材料是__。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
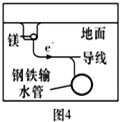
【题目】下列与金属腐蚀有关的说法正确的是( ).
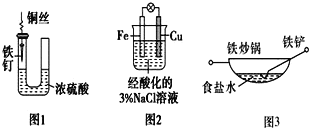
A.图1中,铁钉易被腐蚀
B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
C.图3中,形成了原电池,加速了铁锅、铁铲的腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化硫(S2C12)的结构式为Cl—S—S—Cl,常温下为浅黄色油状液体,遇水即分解:2S2Cl2+2H2O→4HCl+SO2↑+3S↓。下列有关此反应的说法正确的是
A.S2C12做氧化剂,H2O做还原剂
B.每生成l mol SO2转移4 mol电子
C.氧化产物与还原产物的物质的量之比为l:3
D.每生成48g硫会断裂2mol氢氧键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成:
(1)已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0 mol·L-1,若忽略氨水浓度的变化,溶液中的c(OH-)约为_______mol·L-1;0.1 mol ·L-1的(NH4)2SO3溶液显________(填“酸”“碱性”或“中性”)。
(2)某研究性学习小组将下列装置按如图连接,C、D、E、F、X、Y都是惰性电极,甲、乙、丙中电解质溶液含溶质均为1 mol。将电源接通后,向乙中滴入酚猷溶液,在F极附近显红色。试回答下列问题:

①电源A极的名称是__________。
②乙装置中电解反应的总化学方程式:___________。
③当电路中通过4 mole-时,要使甲中溶液种类和浓度均复原,可向电解后溶液中加入_______(填某一种物质的化学式和物质的量)。
④装置丁中的现象是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期主族元素原子半径与原子序数的关系。下列说法错误的是
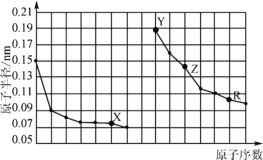
A.X、R的最高化合价相同
B.电解熔融的X与Z构成的化合物可以得到单质Z
C.X、Y形成的化合物中阳离子与阴离子的个数比一定是2:1
D.Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。恒容条件下,下列能使
CH3OH(g)。恒容条件下,下列能使![]() 增大的有
增大的有
A.升高温度B.充入CO气体
C.再充入1 mol CO和2 mol H2D.使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有1950g发烟硫酸(用a SO3H2O 表示),SO3和H2SO4的质量分数分别为0.2和0.8,加b g水稀释成某浓度的硫酸(用H2SO4![]() H2O 表示),则以下正确的是(允许最后一位数字不同)( )
H2O 表示),则以下正确的是(允许最后一位数字不同)( )
A.a=1.38B.a=1.31C.b=174D.b=129
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com