
【题目】下列微粒中含有配位键的是()
![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() 。
。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
【答案】A
【解析】
①H3O+中,O上含有孤电子对,H+有空轨道,可以形成配位键,故①含有配位键;
②NH4+中,N上含有孤电子对,H+有空轨道,可以形成配位键,故②含有配位键;
③[Cu(H2O)4]2+中,Cu2+含有空轨道,H2O中O含有孤电子对,可以形成配位键,故③含有配位键;
④[Fe(SCN)6]3-中,Fe3+含有空轨道,SCN-中S含有孤电子对,可以形成配位键,故④含有配位键;
⑤CuCl42-中,Cu2+含有空轨道,Cl-含有孤电子对,可以形成配位键,故⑤含有配位键;
⑥CH4不含有配位键,故⑥不含有配位键;
⑦NH3不含有配位键,故⑦不含有配位键;
综上,含有配位键的有①②③④⑤,故答案为A。


科目:高中化学 来源: 题型:
【题目】下列关于实验的描述不正确的是( )
A.使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度偏低
B.过滤时,玻璃棒靠在三层滤纸边沿稍下方
C.在镀件上电镀铜时,可用金属铜作阳极
D.在用Fe(OH)3胶体溶液做电泳实验时,阴极区红色加深,可知Fe(OH)3胶体粒子带正电荷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将2molSO2和1mol O2充入一定容积的密闭容器中,在催化剂作用下发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-197kJ·mol-1,当达到化学平衡时,下列说法中正确的是( )
2SO3(g)ΔH=-197kJ·mol-1,当达到化学平衡时,下列说法中正确的是( )
A.SO2和SO3共2molB.生成SO32mol
C.放出197kJ热量D.含氧原子共8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示与对应叙述相符的是

A. 图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS)>Ksp(CuS)
B. 图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
C. 图丙表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
D. 图丁表示反应N2(g)+3H2(g) ![]() 2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“化学实验![]() 观察现象
观察现象![]() 分析推理一得出结论”是化学学习的方法之一,下列说法正确的是
分析推理一得出结论”是化学学习的方法之一,下列说法正确的是![]()
A.检验氯化铁溶液中是否有氯化亚铁,可取待测液加入酸性高锰酸钾溶液中,若酸性高锰酸钾溶液褪色,则证明一定有氯化亚铁
B.将![]() 通入足量稀
通入足量稀![]() 溶液中,溶液由棕黄色变为浅绿色,但立即又变成棕黄色,假设通入的
溶液中,溶液由棕黄色变为浅绿色,但立即又变成棕黄色,假设通入的![]() 完全反应,则同温同压下,逸出的气体和通入的
完全反应,则同温同压下,逸出的气体和通入的![]() 的体积比为2:3
的体积比为2:3
C.验证淀粉的水解产物是否具有还原性,取水解液于试管中并加入新制氢氧化铜悬浊液,加热煮沸,观察是否出现砖红色沉淀
D.向铝质容器中加入食盐溶液,再将变黑的银器浸人该溶液中,一段时后发现黑色褪去,该过程中发生的反应为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列物质的性质,判断其应用错误的是![]()
A.碳酸钠溶液呈碱性,可用于清洗油污
B.水与乙醇以任意比例互溶,可用水洗、分液的方法除去溴乙烷中的乙醇
C.镧镍合金能大量吸收![]() 形成金属氢化物,可作储氢材料
形成金属氢化物,可作储氢材料
D.游泳池中常加入硫酸铜,其主要作用是铜离子水解生成![]() 胶体,能吸咐池中的悬浮物
胶体,能吸咐池中的悬浮物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各情况,在其中Fe片腐蚀由慢到快的顺序是
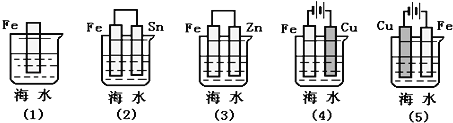
A.(5)(2)(1)(3)(4) B.(5)(1)(2)(4)(3)
C.(4)(2)(1)(3)(5) D.(4)(3)(1)(2)(5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产和生活中有着广泛的应用。
I.氧化铁是重要工业颜料,用废铁屑制备它的流程如图:
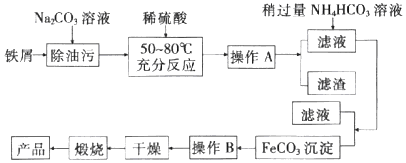
回答下列问题:
![]() 操作A、B的名称分别是______、______;加入稍过量的
操作A、B的名称分别是______、______;加入稍过量的![]() 溶液的作用是______。
溶液的作用是______。
![]() 写出在空气中充分加热煅烧
写出在空气中充分加热煅烧![]() 的化学方程式:______。
的化学方程式:______。
![]() 上述流程中,若煅烧不充分,最终产品中会含有少量的FeO杂质。某同学为测定产品中
上述流程中,若煅烧不充分,最终产品中会含有少量的FeO杂质。某同学为测定产品中![]() 的含量,进行如下实验:
的含量,进行如下实验:
![]() 称取样品
称取样品![]() ,加入足量稀
,加入足量稀![]() 溶解,并加水稀释至100mL;
溶解,并加水稀释至100mL;
![]() 量取
量取![]() 待测溶液于锥形瓶中;
待测溶液于锥形瓶中;
![]() 用酸化的
用酸化的![]() 标准液滴定至终点;
标准液滴定至终点;
![]() 重复操作b、
重复操作b、![]() 次,得出消耗
次,得出消耗![]() 溶液体积的平均值为
溶液体积的平均值为![]() 。
。
![]() 写出滴定过程中发生反应的离子方程式:______。
写出滴定过程中发生反应的离子方程式:______。
![]() 确定滴定达到终点的操作及现象为______。
确定滴定达到终点的操作及现象为______。
![]() 上述样品的质量分数为______。
上述样品的质量分数为______。
![]() 下列操作会导致样品中
下列操作会导致样品中![]() 的质量分数测定结果偏低的有______。
的质量分数测定结果偏低的有______。
![]() 未干燥锥形瓶
未干燥锥形瓶 ![]() 盛装标准液的滴定管没有用标准液润洗
盛装标准液的滴定管没有用标准液润洗
![]() 滴定结束时仰视刻度线读数
滴定结束时仰视刻度线读数![]() 量取待测液的滴定管没有润洗
量取待测液的滴定管没有润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:

已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl—= Fe2++ TiOCl42—+2H2O
(1)化合物FeTiO3中铁元素的化合价是_______。
(2)滤渣A的成分是_______。
(3)滤液B中TiOCl42-和水反应转化生成TiO2的离子方程式是_______ 。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15 溶液时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti元素浸出率下降的原因_ 。

(5)反应③的化学方程式是 。
(6)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是_______。
(7)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)作电极组成电池,其工作原理为:
Li4Ti5O12+ 3LiFePO4![]() Li7Ti5O12+ 3FePO4 该电池充电时阳极反应式是: 。
Li7Ti5O12+ 3FePO4 该电池充电时阳极反应式是: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com