
科目: 来源:模拟题 题型:填空题

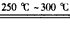 Li2SO4+Al2O3·4SiO2·H2O↓
Li2SO4+Al2O3·4SiO2·H2O↓ 
查看答案和解析>>
科目: 来源:同步题 题型:填空题
查看答案和解析>>
科目: 来源:河北省模拟题 题型:填空题


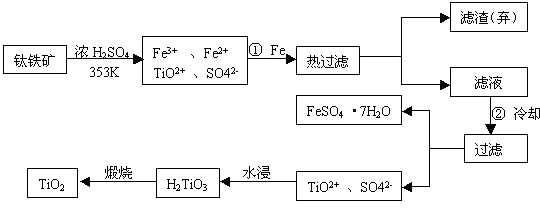
 溶液完全反应后,用浓度为0.02000 mol/L 的 K2Cr2O7标准溶液滴定至终点,消耗 K2Cr2O7溶液25.00ml. 已知:
溶液完全反应后,用浓度为0.02000 mol/L 的 K2Cr2O7标准溶液滴定至终点,消耗 K2Cr2O7溶液25.00ml. 已知: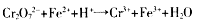 (未配平)
(未配平) 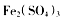 溶液,发生反应的离子方程式为________________________,
溶液,发生反应的离子方程式为________________________, 查看答案和解析>>
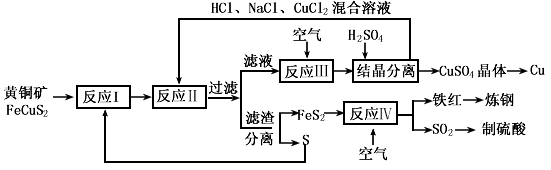
科目: 来源:模拟题 题型:填空题
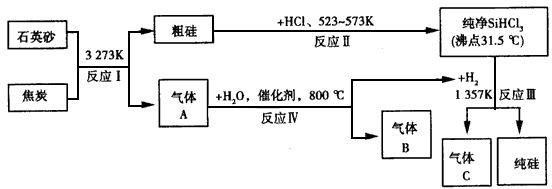
查看答案和解析>>
科目: 来源:广东省高考真题 题型:填空题



查看答案和解析>>
科目: 来源:0115 期末题 题型:填空题
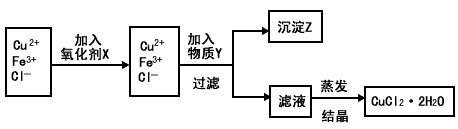


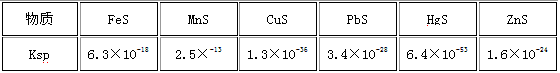
查看答案和解析>>
科目: 来源:江苏模拟题 题型:填空题

查看答案和解析>>
科目: 来源:山西省模拟题 题型:填空题

查看答案和解析>>
科目: 来源:模拟题 题型:填空题

 MnFe2O4-x+O2↑、MnFe2O4-x+xH2O →MnFe2O4+xH2↑,请认真分析上述两个反应并回答下列问题:
MnFe2O4-x+O2↑、MnFe2O4-x+xH2O →MnFe2O4+xH2↑,请认真分析上述两个反应并回答下列问题: 查看答案和解析>>
科目: 来源:模拟题 题型:填空题
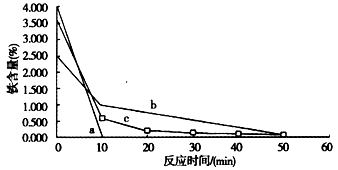
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com