
科目: 来源: 题型:
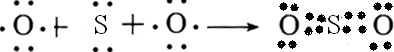
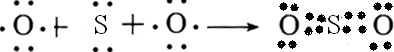
查看答案和解析>>
科目: 来源: 题型:
 (2010?天河区二模)铁及其化合物在日常生活应用广泛,请根据下列实验回答问题:
(2010?天河区二模)铁及其化合物在日常生活应用广泛,请根据下列实验回答问题:
 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH-
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:

 2C
2C 2C
2C| c2(C) |
| c(A)?c2(B) |
| c2(C) |
| c(A)?c2(B) |
| t2~t3 | t4~t5 | t5~t6 | t7~t8 |
| K1 | K2 | K3 | K4 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
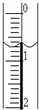 (2009?松江区二模)现使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
(2009?松江区二模)现使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).| 滴定次数 实验数据(mL) |
1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
| 15.95+15.00+15.05+14.95 |
| 4 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
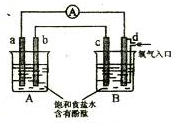 化学实验小组在学习化学电源和氯碱工业相关知识后,在实验室 进行实验验证,
化学实验小组在学习化学电源和氯碱工业相关知识后,在实验室 进行实验验证,查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com