
科目: 来源: 题型:阅读理解
| 催化剂 |
| 高温 |
| c2(NH3) |
| c(N2)?c3(NH3) |
| c2(NH3) |
| c(N2)?c3(NH3) |
| 压强(Mpa) 氨的平衡含(%) 温度(摄氏度) |
0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
查看答案和解析>>
科目: 来源: 题型:
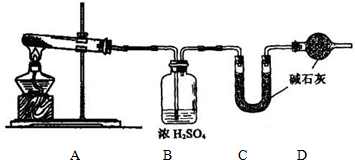 工业上用侯氏制碱法可制得碳酸氢钠晶体,该反应原理可以用以下化学方程式表示:
工业上用侯氏制碱法可制得碳酸氢钠晶体,该反应原理可以用以下化学方程式表示: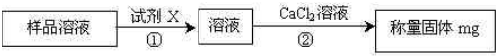
| 21m |
| 25w |
| 21m |
| 25w |
查看答案和解析>>
科目: 来源: 题型:
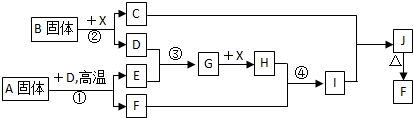
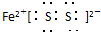
查看答案和解析>>
科目: 来源: 题型:


查看答案和解析>>
科目: 来源: 题型:
| ||
查看答案和解析>>
科目: 来源: 题型:
(2009?湛江二模)从下列事实所得出的相应结论正确的是( )
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com