
科目: 来源: 题型:选择题
| A. | 15g甲基(-CH3)所含有的电子数是10 NA个 | |
| B. | 标准状况下,2.24 L CHCl3的原子总数为0.5 NA个 | |
| C. | 4.2g C3H6中含有的碳碳双键数一定为0.1NA | |
| D. | 常温下,14g乙烯和丙烯的混合物中总原子数为3NA个 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用核磁共振氢谱鉴别1-丙醇和2-丙醇 | |
| B. | 用酸性KMnO4溶液除去乙烷中混有的乙烯 | |
| C. | 间二溴苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构 | |
| D. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 石油裂解的目的是提高柴油等轻质油的产量和质量 | |
| B. | “神州七号”的防护层中含聚四氟乙烯,聚四氟乙烯属于不饱和烃 | |
| C. | 用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用 | |
| D. | 煤经气化和液化两个化学变化过程,可变为清洁能源 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题
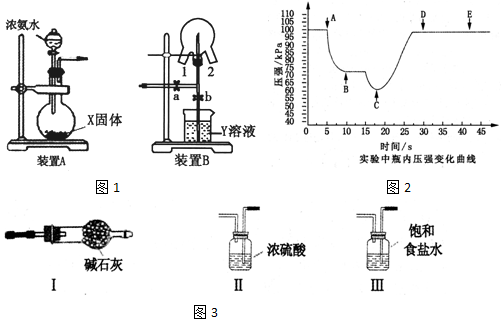
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:推断题
| A | ||
| E |
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com