
科目: 来源: 题型:选择题
| A. | 2.5a×10-4mol | B. | a×10-3mol | C. | 7.5a×10-4mol | D. | a×10-4mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 不慎将酸或碱液溅入眼内,立即闭上眼睛,用手揉擦 | |
| B. | 实验桌上的酒精灯倾倒了燃烧起来,马上用湿布扑灭 | |
| C. | 皮肤上溅有较多的浓硫酸,赶紧用水冲洗 | |
| D. | 衣服沾上大量的浓氢氧化钠溶液,需将此衣服浸泡在盛水的盆中 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
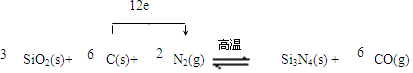 .
.查看答案和解析>>
科目: 来源: 题型:实验题
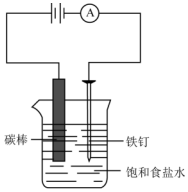 如图所示,回答下列问题:
如图所示,回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | $\frac{1}{2}$ | B. | $\frac{1}{3}$ | C. | $\frac{1}{4}$ | D. | $\frac{1}{5}$ |
查看答案和解析>>
科目: 来源: 题型:实验题
| 气体发生装置 | 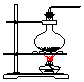 a | 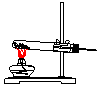 b |  c |
| 气体收集装置 | 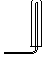 2 | 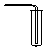 ② | 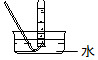 ③ |
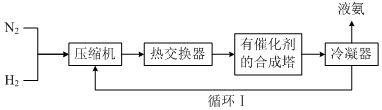
查看答案和解析>>
科目: 来源: 题型:解答题
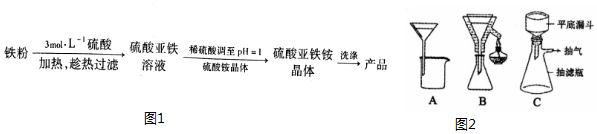
| 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 70℃ |
| FeSO4•7H2O | 28.8 | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2SO4 | 70.6 | 73 | 75.4 | 78.0 | 81 | 84.5 | 94.9 |
| (NH4)2SO4•FeSO4•6H2O | 14.5 | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com