
科目: 来源: 题型:
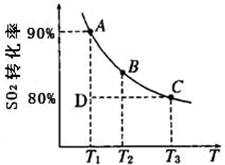 硫及其化合物在国民生产中占有重要的地位.
硫及其化合物在国民生产中占有重要的地位.| 1 | 2 |
查看答案和解析>>
科目: 来源: 题型:
| ||
| ||
| 放电 |
| 充电 |
| ||
查看答案和解析>>
科目: 来源: 题型:
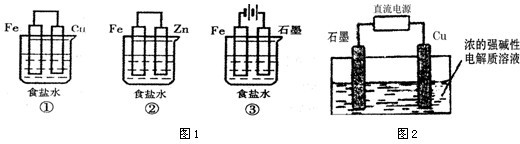
 某学生利用下面实验装置探究盐桥式原电池的工作原理.
某学生利用下面实验装置探究盐桥式原电池的工作原理.查看答案和解析>>
科目: 来源: 题型:
 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目: 来源: 题型:
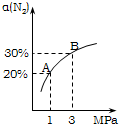 某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.N2的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.N2的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
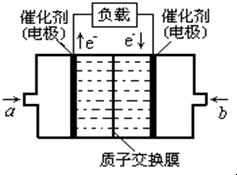 甲醇燃料电池已经面世,其结构示意图如图.甲醇在催化作用下提供质子(H+)和电子,电子经外电路、质子(H+)经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2═2CO2+4H2O,下列说法不正确的是( )
甲醇燃料电池已经面世,其结构示意图如图.甲醇在催化作用下提供质子(H+)和电子,电子经外电路、质子(H+)经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2═2CO2+4H2O,下列说法不正确的是( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com