
科目: 来源: 题型:解答题
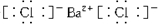 ,③的电子式是
,③的电子式是 .
.查看答案和解析>>
科目: 来源: 题型:解答题
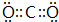 ;
; ;
;查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ③④ | D. | ①⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | N、O、S | B. | Cl、S、O | C. | Si、P、N | D. | S、Cl、F |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | S2-和HS- | B. | H3O+和OH- | C. | Na+和NH${\;}_{4}^{+}$ | D. | K+和Ne |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶 液的体积(mL) | 20.05 | 20.00 | 18.50 | 19.95 |
| 醋酸浓度 (mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol•L-1甲酸溶液的pH约为2 | |
| B. | 甲酸能与水以任意比例互溶 | |
| C. | 10 mL 1 mol•L-1甲酸恰好与10 mL 1 mol•L-1 NaOH溶液完全反应 | |
| D. | 甲酸溶液的导电性比强酸溶液弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com