
科目: 来源: 题型:解答题
 锡有SnCl2、SnCl4两种氯化物.SnCl4是无色液体,极易水解,熔点-36℃,沸点114℃,金属锡的熔点为231℃.实验室用熔融的金属锡跟干燥的氯气直接作用制取无水SnCl4(此反应过程放出大量的热).实验室制取无水SnCl4的装置如图所示.
锡有SnCl2、SnCl4两种氯化物.SnCl4是无色液体,极易水解,熔点-36℃,沸点114℃,金属锡的熔点为231℃.实验室用熔融的金属锡跟干燥的氯气直接作用制取无水SnCl4(此反应过程放出大量的热).实验室制取无水SnCl4的装置如图所示.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | FeO、FeS、CuO、CuS、稀硫酸 | |
| B. | 苯、四氯化碳、无水乙醇、己烯 溴水 | |
| C. | 甲酸、乙酸、乙醛、乙醇 新制氢氧化铜悬浊液 | |
| D. | 苯酚钠溶液、甲苯、乙酸乙酯、乙酸 饱和碳酸钠溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该制备小苏打的方程式为:NaCl+NH4HCO3→NaHCO3↓+NH4Cl | |
| B. | 母液中通入的氨气与HCO3-反应:NH3+HCO3-→CO32-+NH4+ | |
| C. | 加食盐是为增大溶液中Cl-的浓度 | |
| D. | 由题可知温度较低时,氯化铵的溶解度比氯化钠的大 |
查看答案和解析>>
科目: 来源: 题型:解答题
 肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
| 苯甲醛 | 乙酸酐 | 肉桂酸 | 乙酸 | |
| 溶解度(25℃,g/100g水) | 0.3 | 遇热水水解 | 0.04 | 互溶 |
| 沸点(℃) | 179.6 | 138.6 | 300 | 118 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4•7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| 摩尔盐 | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
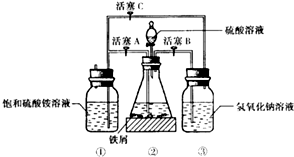
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:选择题
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数 | 1.8×10-4 | 4.9×10-11 | Ki=1.3×10-1 Kr=7.1×10-15 |
| A. | 等物质的量浓度的各溶液pH关系为pH(CH3COONa)>pH(Na2S)>pH(NaCN) | |
| B. | amol/LHCN与bmol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于或等于b | |
| C. | NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) | |
| D. | 某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-dmol/L |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 装置①中,盐桥中的K+移向ZnSO4溶液 | |
| B. | 装置②工作一段时间后,a极附近溶液的pH增大 | |
| C. | 用装置③精炼铜时,c极为粗铜 | |
| D. | 装置④电池负极的电极反应式为:O2+4e-+2H2O=4OH- |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com