
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
| X | ||||
| Y | Z | W |
 .
.| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目: 来源: 题型:解答题
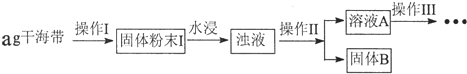
| 序号 | 实验操作 | 实验现象 | 结论 |
| ① | 取少量稀释后的溶液A加入淀粉后再用硫酸酸化,分装于试管Ⅰ、Ⅱ | 无现象 | |
| ② | 往试管I中加入FeCl2溶液,后加入2滴KSCN溶液并振荡; | 无现象 | 证明不是以IO3-形式存在 |
| ③ | 往试管II中加入3%H2O2溶液并振荡 | 溶液变蓝 | 证明以I-形式存在 |
查看答案和解析>>
科目: 来源: 题型:选择题
| … | W | |||
| X | Y | … | Z |
| A. | X、Y、Z、W的原子半径依次减小 | |
| B. | W与X形成的化合物中只含有离子键 | |
| C. | 气态氢化物的稳定性:W>Z | |
| D. | W与Y形成的化合物可分别与NaOH溶液和盐酸反应 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 单位时间内生成n mol A2的同时消耗n mol A2 | |
| B. | 容器内的各组分的浓度不随时间变化而变化 | |
| C. | 单位时间内生成2n mol AB的同时生成n mol B2 | |
| D. | A2、B2和AB的分子数之比为1:1:2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 苯与氢气在一定条件下反应生成环己烷 | |
| C. | 苯与浓硝酸和浓硫酸的混合液反应生成油状液体 | |
| D. | 乙烯与溴的四氯化碳溶液反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 存在于氧气和三氧化硫中 | B. | 只存在于三氧化硫中 | ||
| C. | 三种物质中都有 | D. | 无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com