
科目: 来源: 题型:
【题目】【化学---选修3:物质结构与性质】原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,Y原子基态时最外层电子数是其内层电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构。回答下列问题:

(1)W基态原子的价电子排布式____________;Y2X2分子中Y原子轨道的杂化类型为______。
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是_____________。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是____________。Y60用做比金属及其合金更为有效的新型吸氢材料,其分子结构为球形32面体,它是由60个Y原子以20个六元环和12个五元环连接而成的具有30个Y=Y键的足球状空心对称分子。则该分子中σ键和π键的个数比_____;36gY60最多可以吸收标准状况下的氢气_____L。
(4)元素W的一种氯化物晶体的晶胞结构如右图所示,该氯化物的化学式是___________,该晶体中W的配位数为___________。它可与浓盐酸发生非氧化还原反应,生成配合物HnWCl3,反应的化学方程式为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图所示:

(1)写出反应I、II的化学方程式(不必写反应条件):
I、 ;II ;III、2HI![]() H2+I2
H2+I2
(2)整个过程中起到了催化作用的物质是 (写化学式)。
(3)一定温度下,向2L密闭容器中加入1molHI(g),发生反应III,生成的I2为气体,H2物质的量随时间的变化如图所示。则0-2min内的平均反应速率v(HI)= ,能作为该反应达到平衡状态判断依据的是 。
①n(H2)=n(I2) ②压强不再变化 ③气体密度不再变化
④2个H-I断裂的同时,有1个H-H断裂 ⑤各组分浓度保持不变
⑥c(HI):c(H2):c(I2)=2:1:1
(4)已知有关键能数据:I2-151kJ/mol、H2-436kJ/mol、HI-298kJ/mol,则当有0.2molHI分解时的能量变化是 (填“吸收”或“放出”) kJ的热量。
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学——选修5:有机化学基础】奥沙拉秦是种抗菌药。其合成路线如下:

已知:①NaNO2具有强氧化性
 ②
②
(1)水杨酸中所含官能团的名称是___________。
(2)A的分子式是___________。
(3)B→C的化学方程式___________。
(4)整个合成路线看,设计B→C步骤的作用是___________。
(5)D的结构简式是___________。D→E的反应类型是___________。
(6)有机物G(结构简式见右上图)也可用于合成奥沙拉秦。它的一种同分异构体X是α-氨基酸,能与FeCl3溶液发生显色反应,这样的结构有_____种,写出一种X可能的结构简式________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用含铜、铁的粗锌制备硫酸锌及相关物质。工艺流程图及有关数据如下:

物质 | Cu(OH)2 | Zn(OH)2 | Fe(OH)3 | ZnS | CuS |
Ksp | 5.0×10-20 | 2.0×10-16 | 4.0×10-38 | 1.2×10-23 | 8.5×10-45 |
请回答下列问题:
(1)粗锌中的铜与混酸的稀溶液反应的化学方程式为__________________________,图中处理气体X要能够体现绿色化学思想,还需补充气体______(填化学式)。
(2)若溶液I中c(Cu2+)为0.05mol·L-1,则溶液II中c(Fe3+)>____mol·L-1。
(3)若固体A是Zn,取9.61 g固体C溶解于足量的500mL 2 mol·L-1稀硝酸中,共收集到标准状况下2.24L的气体,向所得溶液中加入2 mol·L-1NaOH溶液,则当生成沉淀最多时,沉淀的质量为_____g;若固体A是另一种物质,取部分固体C于试管中,加入盐酸产生有臭鸡蛋味气体,则该反应的离子方程式为________________________。
(4)溶液Ⅲ经过蒸发浓缩、____________、过滤、洗涤、干燥,即得到较纯净的硫酸锌晶体;溶液还可以制备ZnS,实际选择的是(NH4)2S溶液而不是Na2S溶液作为反应物,理由是后者制得的ZnS含有较多的杂质,则该杂质是____________(填化学式)。
(5)金属锌常用作酸性干电池的负极,干电池不使用时,由于负极与电解质溶液接触而发生自放电反应:2NH4++Zn=2NH3+H2↑+Zn2+,造成电量自动减少。写出铅蓄电池不使用时,其正极上发生自放电的化学方程式__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知单质硫在通常条件下以S8(斜方硫)的形式存在,而在蒸气状态时,含有S2、S4、S6及S8等多种同素异形体,其中S4、S6和S8具有相似的结构特点,其结构如下图所示:

回答下列问题:
(1)下列有关说法正确的是 。
A.S2、S4、S6、S8互为同系物 B.S8转化为S6、S4、S2属于物理变化
C.不论哪种硫分子,完全燃烧时都生成SO2 D.常温条件下单质硫为原子晶体
E.32gS8单质含有的S—S键个数为NA
(2)在一定温度下,测得硫蒸气的平均摩尔质量为80g/mol,则该蒸气中S2分子的体积分数不小于 。
(3)在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)。反应过程和能量关系可用下图简单表示(图中的ΔH表示生成1mol产物的数据)。

①写出表示S8燃烧的热化学方程式_____________。
②写出SO3分解生成SO2和O2的热化学方程式_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(化学—选修3:物质结构与性质)
氮化硼(BN)被称为一种“宇宙时代的材料”,具有很大的硬度。
(1)基态硼原子有__________个未成对电子,氮离子的电子排布式为__________。
(2)部分硼的化合物有以下转化:![]()
则下列叙述正确的是__________(填序号);
A.B3N3H6俗称无机苯,但不是平面分子
B.BNH6与乙烷是等电子体
C.HB≡NH中的硼原子、氮原子韵杂化类型相同
D.硼、氮、氧三元素的第一电离能比较:B<N<O
(3)下图的晶体结构中,黑球白球分别代表不同的原子、离子或分子,则图1的晶胞中含有的粒子总数为__________;图2中的白球的配位数是__________。

(4)已知图3、4均表示BN晶体的结构,制备氮化硼的原理为:BCl3+2NH3=BN+2HCl+NH4Cl,当该反应中有1mol BN生成时,则反应中可形成__________mol配位键,比较氮化硼晶体与晶体硅的沸点高低并解释原因____________________。
(5)X射线的衍射实验可获取晶体的结构,包括晶胞形状、大小及原子的分布等参数,从而提供了又一种实验测定阿伏加德罗常数和元素的相对质量的方法。若图4晶胞的棱长为a nm,密度为ρ g·cm-3,则阿伏加德罗常数为__________(要求化为最简关系)。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是
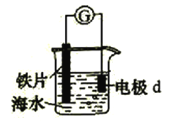
A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2+ 2H2O + 4e = 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H++ 2e = H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】苯胺为无色液体,还原性强,易被氧化;有碱性,与酸反应生成盐。常用硝基苯与H2制备:![]() 。
。
其部分装置及有关数据如下: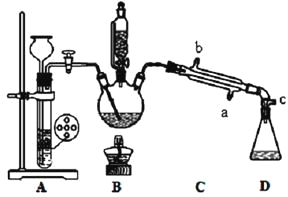
沸点/℃ | 密度g/mL | 溶解性 | |
硝基苯 | 210.9 | 1.20 | 不溶于水,易溶于乙醇、乙醚 |
苯胺 | 184.4 | 1.02 | 微溶于水,易溶于乙醇、乙醚 |
乙醚 | 34.6 | 0.71 | 不溶于水,易溶于硝基苯、苯胺 |
实验步骤:
①检查装置的气密性,连接好C处冷凝装置的冷水。
②先向三颈烧瓶中加入沸石及硝基苯,再取下恒压分液漏斗,换上温度计。
③打开装置A、B间活塞,通入H2一段时间。
④点燃B处的酒精灯,加热,使温度维持在140℃进行反应。
⑤反应结束后,关闭装置A、B间活塞,加入生石灰。
⑥调整好温度计的位置,继续加热,收集182~186℃馏分,得到较纯苯胺。
回答下列问题:
(1)步骤⑥中温度计水银球的位置在__________。
(2)下列关于实验的叙述中,错误的是__________。
A.冷凝管的冷水应该从b进从a出
B.实验开始酎,温度计水银球应插入反应液中,便于控制反应液的温度
C.装置A中应使用锌粉,有利于加快生成H2的速率
D.加入沸石的目的是防止暴沸
(3)若实验中步骤③和④的顺序颠倒,则实验中可能产生的后果是_____________。
(4)蒸馏前,步骤⑤中加入生石灰的作用是____________________。
(5)有学生质疑反应完成后,直接蒸馏得到苯胺的纯度不高,提出以下流程:

苯胺在酸性条件下生成盐酸苯胺被水萃取,在碱性溶液中又被放有机溶剂反萃取,这种萃取——反萃取法简称反萃。实验中反萃的作用是__________;在分液漏斗中进行萃取分液时,应注意不时放气,其目的是____________________。
(6)苯胺还原性强,易被氧化,请配平下列化学方程式的化学计量数。
查看答案和解析>>
科目: 来源: 题型:
【题目】1.52g 铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )。
A. 该合金中铜与镁的物质的量之比是2:1
B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C. NO2和N2O4的混合气体中,NO2的体积分数是80%
D. 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目: 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:① N2(g) + O2(g) ![]() 2NO(g) △H1=+180.5 kJ·mol-1
2NO(g) △H1=+180.5 kJ·mol-1
② C和CO的燃烧热(△H)分别为-393.5 kJ·mol-1和-283 kJ·mol-1
则2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g)的△H = kJ·mol-1
N2(g) + 2CO2(g)的△H = kJ·mol-1
(2)将0.20 mol NO和0.10 mol CO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。

①CO在0-9min内的平均反应速率v(CO)=_______________ mol·L﹣1·min﹣1 (保留两位有效数字);第12 min时改变的反应条件可能为________。
A.升高温度 B.加入NO C.加催化剂 D.降低温度
②该反应在第24 min时达到平衡状态,CO2的体积分数为__________(保留三位有效数字),化学平衡常数K=___________(保留两位有效数字)。
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。
(4)通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2。已知常温下0.1 mol·L﹣1的HCOONa溶液pH =10,则HCOOH的电离常数![]() =___________________。
=___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com