
科目: 来源: 题型:
【题目】(1)一种气态烷烃和一种气态烯烃组成的混合物共10g,混合气体的密度是相同状况下氢气的12.5倍,该混合气体通过溴水时,溴水的质量增加8.4g。则该烷烃与烯烃的体积比为:________________。
(2)一定质量的甲烷燃烧后得到的产物为CO、CO2和水蒸气,此混合气体质量为49.6 g,当其缓缓通过无水CaCl2时,CaCl2的质量增加22.5 g。原混合气体中CO2的质量为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应:3A(g)+B(g) ![]() 2C(g) +2D(g) 在不同条件下的反应速率分别为:
2C(g) +2D(g) 在不同条件下的反应速率分别为:
(1)v(A)=0.6molL-1min-1 (2) v(B)=0.007 molL-1S-1
(3)v(C)=0.4 molL-1min-1 (4) v(D)=0.80 molL-1min-1
此反应在不同条件下进行最快的是 ( )
A.(1) B.(2) C.(3) D.(4)
查看答案和解析>>
科目: 来源: 题型:
【题目】有人设计了如图所示实验,以确认某混合气体中含有C2H4和SO2。

混合气体
所需试剂有
A.品红溶液 B.NaOH溶液
C.浓H2SO4 D.酸性高锰酸钾溶液
试回答下列问题:
(1)写出图中①、②、③、④装置可盛放的试剂(将上述有关试剂的序号填入空格内):
①________,②________,③________,④________。
(2)使用装置②的目的是_____________________________________________________。
(3)写出SO2与酸性高锰酸钾反应的离子方程式:
____________________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】按下图装置进行实验,并回答下列问题

(1)判断装置的名称:A池为 B池为 。
(2)铜极为______极,电极反应式为 。
(3)B装置中,C1与C2均为石墨棒,石墨棒C1为___极,电极反应式为 ,石墨棒C2附近发生的实验现象为 。
(4)当C2极析出224mL(标准状态)气体时,锌的质量减少 g.
查看答案和解析>>
科目: 来源: 题型:
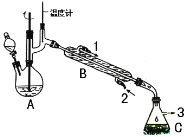
【题目】在有机反应中加氧去氢的反应叫氧化反应,去氧加氢的反应叫还原反应,如乙烯与氢气的加成反应也叫还原反应。1-苯乙醇因具有玫瑰香气味而广泛用于各种食用香精中,实验室用苯乙酮制备1-苯乙醇的反应、装置示意图和有关数据如下:

试剂[ | 熔点/℃[ | 沸点/℃ | 密度/g·cm-3 | 溶解性 | ||
水 | 乙醇 | 乙醚 | ||||
1-苯乙醇 | 20 | 203.4 | 1.013 | 不溶 | 溶 | 溶 |
苯乙酮 | 19.7 | 202.3 | 1.028 | 不溶 | 溶 | 溶 |
硼氢化钠 | 36 | 400 | 1.076 | 溶 | 溶 | 不溶 |
乙醇 | -117.3 | 78.4 | 0.789 | 溶 | - | 溶 |
乙醚 | -116.3 | 34.6 | 0.713 | 微溶 | 溶 | - |
实验步骤:
在A中加入15mL 95%的乙醇和1.0g硼氢化钠,搅拌下再滴入8mL苯乙酮,然后在搅拌的条件下,滴加足量的3mol·L-1的盐酸;使A中反应液的温度保持在75-80℃,使其中大部分乙醇蒸发,出现分层,再加入10mL乙醚。将混合反应液倒入分液漏斗中分液,水层再用10mL乙醚萃取,合并两次有机相,再进行简单蒸馏除去乙醚。最后经提纯收集到1-苯乙醇4.5g。
回答下列问题:
(1) 苯乙酮制备1-苯乙醇的反应类型是 ;
(2)仪器B的名称为______________;
(3)反应完成后,加入10mL乙醚,充分振荡后,上层为__________(填“水层”或“有机层”)
(4)反应中加入乙醇的目的是________________________________;
(5)两次合并的有机相进行蒸馏除去乙醚,采用的最佳加热方式是_________(填字母),若回收乙醚,则收集馏分的温度范围是____________________;
a.酒精为加热 b.水浴加热 c.油浴加热 d.酒精喷灯加热
(6)本实验的产率为_____________(保留两位有效数字)。
(7) 1-苯乙醇除用作香料外也用于有机合成,如1-苯乙醇与冰醋酸酯化反应制得乙酸苏合香酯,写出此反应化学反应方程式______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)工业上用FeCl3溶液刻蚀铜的线路板,反应为Cu+2FeCl3= CuCl2+ 2FeCl2 依据此氧化还原反应,设计成原电池。现给出铁棒、铜棒、石墨电极,原电池的负极为 ,正极电极反应方程式 ,若负极减重6.4克,则电路中转移电子的物质的量为 。
(2)在一密闭的2L的容器里装有4mol SO2和2mol O2,在一定条件下开始反应。2min末测得容器中共有5.6mol 气体,试计算:
(1)2min末SO3的浓度 。
(2)用SO2表示该反应的平均反应速率 。
查看答案和解析>>
科目: 来源: 题型:
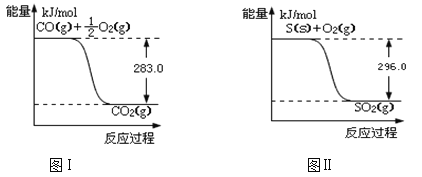
【题目】一氧化碳是一种用途广泛的化工基础原料。有机物加氢反应中镍是常用的催化剂。但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为弄清该方法对催化剂的影响,查得资料如下:
回答下列问题:
(1)SO2(g) + 2CO(g) ![]() S(s) + 2CO2(g) △H = ;该反应的平衡常数的表达式是 。
S(s) + 2CO2(g) △H = ;该反应的平衡常数的表达式是 。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) ![]() CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 ,H2的平均生成速率为 mol·L-1·min-1。
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 ,H2的平均生成速率为 mol·L-1·min-1。
(3)为减少雾霾、降低大气中有害气体含量,研究机动车尾气中CO、NO及CxHy的排放量意义重大。机动车尾气污染物的含量与空/燃比(空气与燃油气的体积比)的变化关系如图所示。

已知:N2与O2生成NO的反应是吸热反应。请解释:
①随空/燃比增大,CO和CxHy的含量减少的原因是 。
②当空/燃比达到15后,NO减少的原因可能是 。
(4)一定条件下H2与CO合成CH3OH,CH3OH再转化成为CH3OCH3,转化的热化学反应方程式如下:2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-24.5 kJ·mol-1
在250℃、压强不变的密闭容器中,加入2mol的CH3OH,一段时间后上述反应达平衡,体系放出热量11 kJ;若同一条件下加入0.2mol CH3OCH3和0.2mol H2O,一段时间后上述反应达平衡,体系的热效应为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】研究化学反应速率有重要的意义。对于2A(g)+B(g)![]() 3C(g)+4D(g),
3C(g)+4D(g),
下列反应速率最快的是( )
A.vB= 0.3 mol·L-1·min-1 B.vA= 0.5 mol·L-1·min-1
C.vC= 0.8 mol·L-1·min-1 D.vD= 1 mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】请根据官能团的不同对下列有机物进行分类(填序号)。

(1)芳香烃:_____________ ;(2)卤代烃:_____________;(3)醇:_______________ ;
(4)酚:_____________;(5)醛:_______________ ;(6)酮:_____________;
(7)羧酸:_____________ ;(8)酯:_____________。
查看答案和解析>>
科目: 来源: 题型:
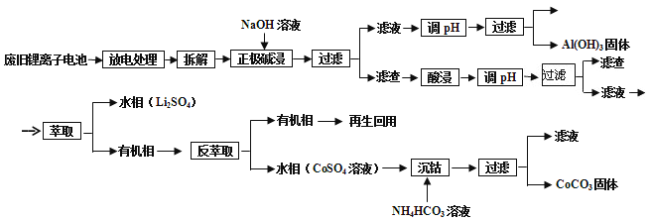
【题目】锂电池应用很广,某种锂离子电池,其正极材料可再生利用。其正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe-=LixC6,现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。
回答下列问题:
(1)写出“正极碱浸”中发生反应的化学方程式____________;
(2)“酸浸”一般在80℃下进行,写出该步骤中发生的主要氧化还原反应的化学方程式________________________;如果可用盐酸代替H2SO4和H2O2的混合溶液,可能发生反应的离子方程式___________________________;
(3)写出“沉钴”过程中发生反应的化学方程式______________________________;
(4)充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出充电时正极的电极反应_____________________________________;
(5)在整个回收工艺中,可回收到的金属化合物有____________(填化学式);
(6)最近美国和韩国的科学家合作研究出新型锂—空气电池,他们的锂—空气电池在放电过程中产生稳定的晶状超氧化锂(LiO2),超氧化锂可以很容易地分解成锂和氧,从而具有更高的效率和更长的循环寿命。请写出该电池正极的电极反应 ____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com