
科目: 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大;A是周期表中原子半径最小的元素;B元素的最高价氧化物的水化物与其简单氢化物能相互反应生成盐;C元素原子的最外层电子数是内层电子数的3倍;D元素的主族序数等于其周期数;E元素原子的最外层电子数是其电子层数的2倍。G单质是日常生活中用量最大的金属,易被腐蚀。
试回答下列问题:
(1)A元素的同位素有___________(写原子符号)
(2)实验室制取B的简单氢化物的化学反应方程式为_________________________
(3)C、D、E、F的简单离子半径由大到小的顺序是_________________(用离子符号表示)
(4)用化学事实说名E与F这两种元素非金属性的强弱_____________________(举一例)
(5)下列有关G的说法不正确的是_______
A、铁位于第四周期ⅧB族,在人体内的血红蛋白中含有铁元素
B、过量的铁分别与氯气和稀盐酸反应所得氯化物相同
C、FeCl3、FeCl2、Fe(OH)3都可以通过化合反应制取
D、氢氧化铁与HI溶液仅发生中和反应
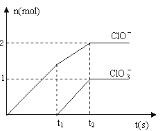
(6)向NaOH溶液中通入一定量的F单质,两者恰好完全反应,生成物中有三种含F的离子,其中两种离子的物质的量与反应时间的曲线如图所示。请写出t2时反应的总的化学方程式 _____________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】用1L 1.0molL-1NaOH溶液吸收0.8molSO2,所得溶液中的SO32-和HSO3-的物质的量浓度之比最接近于( )
A.2:1 B.1:3 C.3:2 D.2:3
查看答案和解析>>
科目: 来源: 题型:
【题目】利用下图装置测定中和热的实验步骤如下:

①量取50mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。请回答:
(1)如右图所示,仪器A的名称是_________ ______;
(2)NaOH溶液稍过量的原因 ____________________________。
(3)加入NaOH溶液的正确操作是_______(填字母)。
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(4)使硫酸与NaOH溶液混合均匀的正确操作是 ________ __________________。
(5)设溶液的密度均为1g·cm-3,中和后溶液的比热容c=4.18 J·(g·℃)-1,请根据实验数据写出该中和热的热化学方程式_______________________________

(6)上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(7)怎样才能确保读取混合液的最高温度?_______ ____________________
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,反应X2(g)+H2(g)![]() 2HX(g)的平衡常数为100。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
2HX(g)的平衡常数为100。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
A. 5% B. 17% C. 25% D. 33%
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最小的是________(填元素符号),其中C原子的外围电子排布图为________。
(2)A和B的氢化物所属的晶体类型分别为_________和_________。
(3)B、C均可以与D形成化合物,其中熔点较高的是____(用化学式表示)
(4)A和B可形成1:1型的化合物E,E的电子式为_____
(5)化合物D2A的立体构型为_________,中心原子的孤电子对数为_________,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_______________。
(6)A和B能够形成化合物F,其晶胞结构如图所示,晶胞边长为0.566nm, F 的化学式为______;晶胞中A 原子的配位数为______;晶体F的密度=______g.cm-3(只列式,不计算)

查看答案和解析>>
科目: 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下图所示:

(1)请列举海水淡化的一种方法____________。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、________、________。
(3)步骤Ⅰ中已经获得Br2,步骤Ⅱ中又将获得的Br2还原为Br-,其目的是____________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,该反应的离子方程式为_____________________________________。由此反应可知,除保护环境外,在工业生产中还应解决的问题是__________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com