
科目: 来源: 题型:
【题目】本题为《化学反应原理(选修4)》选做题。
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
(1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色,则该溶液呈_____性,原因是___________;(用离子方程式表示)
(2)在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的pH值等于___________;
(3)已知在H2S溶液中存在下列平衡:H2S![]() HS-+H+
HS-+H+
①向H2S溶液中加入NaOH固体时,(不考虑温度变化)电离平衡向______移动,(填“左”或“右”)c(H+)_________。(填“增大”、“减小”或“不变”)
②向H2S溶液中加入NaHS固体时,电离平衡向______移动,(填“左”或“右”)c(S2-)_________。(填“增大”、“减小”或“不变”)
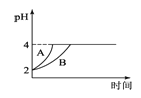
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图1所示.则图中表示醋酸溶液中pH变化曲线的是________(填“A”或“B”);
(5)难溶电解质在水溶液中存在溶解平衡。某MgSO4溶液里c(Mg2+)=0.002molL-1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于________;(该温度下Mg(OH)2的Ksp=2×10-11)
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照表中所示方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是 。
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为 。
(3)实验①和②的目的是 。
实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2 稳定,不易分解。为了达到实验目的,你对原实验方案的改进是 。
(4)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。

分析图像能够得出的实验结论是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】中国古代四大发明之一的黑火药,它的爆炸反应为:
2KNO3+3C+S![]() A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
①除S外,上列元素的电负性从大到小依次为 。
②在生成物中,A的晶体类型为 ;含极性共价键的分子的中心原子轨道杂化类型为___________________。
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为_______ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列字母分别代表某一化学元素。

(1)下列 (填写编号)组元素的单质具有良好导电性。
①a、c、m ②b、g、k ③c、h、1 ④d、e、f
(2)电离能主要取决于原子核对核外电子的吸引力和形成稳定结构的倾向。下表是一些气态原子各级电离能的数据(kJ·mol-1):
锂 | X | Y | |
失去一个电子 | 519 | 502 | 580 |
失去二个电子 | 7296 | 4570 | 1820 |
失去三个电子 | 11799 | 6920 | 2750 |
失去四个电子 | 9550 | 11600 |
①为什么锂原子的第二电离能远远大于第一电离能 。
②用电子式表示X和j以原子个数1比1形成的一种化合物 。
③Y在周期表中是 族元素。
④e元素的电子排布式为
查看答案和解析>>
科目: 来源: 题型:
【题目】NaCl和NaClO在酸性条件下可发生反应:ClO-+ Cl-+2H+![]() Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况。
Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况。
(1)此消毒液中NaClO可吸收空气中的CO2生成NaHCO3和HClO而变质。写出化学反应方程式: 。
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过以下装置检验气体的成分,从而判断该消毒液是否变质。
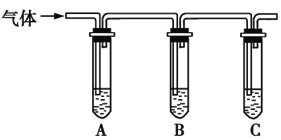
限选试剂:98%浓硫酸、1%品红溶液、1.0 mol·L-1KI-淀粉溶液、1.0 mol·L-1NaOH溶液、澄清石灰水、饱和NaCl溶液。
请完成下列实验方案。
所加试剂 | 预期现象和结论 |
向试管A中加足量①; | 若A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊,则消毒液部分变质; |
(3)用滴定法测定消毒液中NaClO的浓度。实验步骤如下:
①量取 25.00 mL消毒液放入锥形瓶中,加入过量的a mol·L-1Na2SO3溶液b mL。
②滴定分析。将c mol·L-1的酸性KMnO4溶液装入 (填“酸式”或“碱式”)滴定管中滴定,使KMnO4和剩余的Na2SO3发生反应。当溶液由无色变成浅红色,且半分钟内红色保持不褪去时,停止滴定,记录数据。重复滴定实验3次,测得平均消耗酸性KMnO4溶液V mL;滴定过程中涉及的反应有:NaClO+Na2SO3![]() NaCl+Na2SO4 ;2KMnO4+5Na2SO3+3H2SO4
NaCl+Na2SO4 ;2KMnO4+5Na2SO3+3H2SO4![]() K2SO4+2MnSO4+5Na2SO4+3H2O。
K2SO4+2MnSO4+5Na2SO4+3H2O。
③计算。消毒液中NaClO的浓度为 mol·L-1(用含a、b、c、V的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于糖类、油脂、蛋白质的说法中正确的是
A.糖类都能发生水解反应
B.葡萄糖与果糖是同分异构体,淀粉与纤维素也是同分异构体
C.利用油脂在碱性条件下的水解,可以制甘油和肥皂
D.蛋白质溶液中,加入浓的硫酸铵溶液有沉淀析出,属于蛋白质的变性
查看答案和解析>>
科目: 来源: 题型:
【题目】2013年12月17日,中国国土资源部召开新闻发布会,宣布在广东沿海珠江口盆地东部海域首次钻获高纯度可燃冰。可燃冰的主要成分是甲烷,甲烷既是清洁的燃料,也是重要的化工原料。
(1)甲烷和二氧化碳重整制合成气,对于温室气体的治理具有重大意义。
已知:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)ΔH=+247.3 kJ·mol-1
2CO(g)+2H2(g)ΔH=+247.3 kJ·mol-1
CH4(g)![]() C(s)+ 2H2(g) ΔH=+75 kJ·mol-1
C(s)+ 2H2(g) ΔH=+75 kJ·mol-1
①反应2CO(g)![]() C(s)+CO2(g)在一定条件下能自发进行的原因是 。
C(s)+CO2(g)在一定条件下能自发进行的原因是 。
②合成甲醇的主要反应是:2H2(g)+CO(g)![]() CH3OH(g)ΔH=-90.8 kJ·mol-1,T ℃下此反应的平衡常数为160。某时刻测得各组分的浓度如下:
CH3OH(g)ΔH=-90.8 kJ·mol-1,T ℃下此反应的平衡常数为160。某时刻测得各组分的浓度如下:
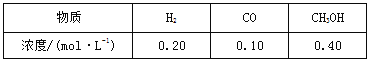
比较此时正、逆反应速率的大小:v(正) v(逆)(填“>”、“<”或“=”)。生产过程中,合成气要进行循环,其目的是 。
③在一恒容密闭容器中,要提高反应2H2(g)+CO(g)![]() CH3OH(g)中CO的转化率,可以采取的措施是 。
CH3OH(g)中CO的转化率,可以采取的措施是 。
a.升温
b.加入催化剂
c.增加CO的浓度
d.加入H2
e.加入惰性气体
f.分离出甲醇
(2)以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。
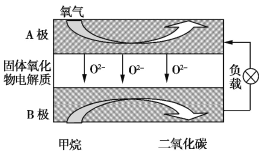
①B极为电池 极,电极反应式为 。
②若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗甲烷的体积为 (标况下)。
查看答案和解析>>
科目: 来源: 题型:
【题目】锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiCIO4。溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。

回答下列问题:
(1)外电路的电流方向是由____极流向____极。(填字母)
(2)电池正极反应式为__ __。
(3)是否可用水代替电池中的混合有机溶剂?____(填“是”或“否”),原因是_________ ___。
(4)MnO2可与KOH和KClO3,在高温下反应,生成K2MnO4,反应的化学方程式为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )

A.反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol 电子
3H2+CO,每消耗1molCH4转移12mol 电子
B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C.电池工作时,CO32-向电极B移动
D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学——选修5:有机化学基础】
有机物G(分子式为C13H18O2)是一种香料,如图是该香料的一种合成路线。
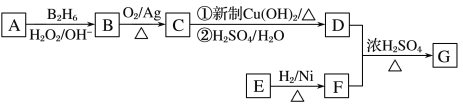
已知:
①E能发生银镜反应,在一定条件下,1 mol E能与2 mol H2反应生成F;
②R—CH===CH2  R—CH2CH2OH;
R—CH2CH2OH;
③有机物D的摩尔质量为88 g·mol-1,其核磁共振氢谱有3组峰;
④有机物F是苯甲醇的同系物,苯环上只有一个无支链的侧链。
回答下列问题:
(1)用系统命名法命名有机物B________________。
(2)E的结构简式为__________________________。
(3)C与新制Cu(OH)2反应的化学方程式为________________________________________。
(4)已知有机物甲符合下列条件:①为芳香族化合物;②与F互为同分异构体;③能被催化氧化成醛。符合上述条件的有机物甲有________种,写出一种满足苯环上有3个侧链,且核磁共振氢谱有5组峰,峰面积比为6:2:2:1:1的有机物的结构简式____________________。
(5)以丙烯等为原料合成D的路线如下:
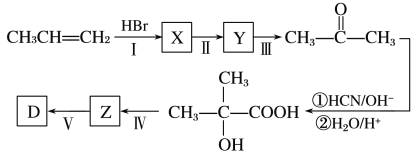
X的结构简式为_______,步骤Ⅱ的反应条件为___________,步骤Ⅳ的反应类型为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com