
科目: 来源: 题型:
【题目】为了测定含有H2C2O4·2H2O、KHC2O4和K2SO4的试样中各物质的质量分数,进行如下实验:
①称取6.0 g试样,加水溶解,配成250 mL试样溶液。
②用酸式滴定管量取25.00 mL试样溶液放入锥形瓶中,并加入2~3滴酚酞试液,用0.2500 mol/L NaOH溶液滴定,消耗NaOH溶液20.00 mL。
③再取25.00 mL试样溶液放入另一锥形瓶中,用0.1000 mol/L的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液16.00 mL。
回答下列问题:
(1)已知:0.10mol/LKHC2O4溶液pH约为3,其中含碳元素的粒子浓度由大到小的顺为 。
(2)步骤①所需要的玻璃仪器有烧杯、玻璃棒、 。
(3) 完成并配平下列离子方程式:
C2O42- + MnO4—+ H+ = CO2↑+ Mn2+ +
(4)步骤③中判断滴定终点的方法是 。
(5)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的H2C2O4·2H2O的质量分数 。(填“偏大”、“偏小”或“无影响”)
(6)试样中H2C2O4·2H2O的质量分数为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】具有下列电子排布式的原子中,半径最大的是
A. ls22s22p63s23p3
B. 1s22s22p3
C. 1s22s22p4
D. 1s22s22p63s23p4
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中错误的是( )
A.卤化氢中,以HF沸点最高,是由于HF分子间存在氢键
B.邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低
C.N2分子中有一个σ键,2个π键
D.在元素周期表中,s区,d区和ds区的元素都是金属
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上需要利用一批回收的含铜废料制造胆矾(CuSO4·5H2O)。该废料中各种成份含量如下:Cu和CuO约占87%,其它为Mg、Al、Fe、Si及其氧化物,还有少量的难溶物质。工艺流程为:

部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH如下表:
沉淀物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
pH | 5.2 | 3.1 | 6.7 | 9.4 | 9.7 |
请回答下列问题:
(1)步骤①中为什么要将含铜废料研磨成粉状? 。
(2)步骤②中的离子方程式(写出2个即可):
、
。
(3)步骤⑤中H2O2参加反应的离子方程式: 。
(4)步骤⑥中调节溶液pH时适宜的物质是 (填序号)。
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Cu(OH)2 E.MgCO3
(5)步骤⑦中用硫酸调节pH=2~3的原因是 。
(6)步骤⑧的分离方法步骤是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大。其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子。请根据以上信息,回答下列问题(用所对应的元素符号表示):
(1)A、B、E的第一电离能由小到大的顺序为 。
(2)氢化物A2H4分子中A原子采取 杂化。
(3)按原子的外围电子排布分区,元素F在 区,基态F原子的电子排布式为 。
(4)元素A和C可形成一种新型化合物材料,其晶体具有很高的硬度和熔点,其化合物中所含的化学键类型为 。
(5)A、F形成某种化合物的晶胞结构如下图所示(其中A显﹣3价,每个球均表示1个原子),则其化学式为 。设阿伏加德罗常数为NA,距离最近的两个F原子的核间距为a cm,则该晶胞的密度为(用含a和NA的代数式表示) g/cm3。
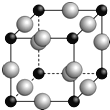
查看答案和解析>>
科目: 来源: 题型:
【题目】2015年12月9日据英国《金融时报》网站报道,化学教授克莱尔·格雷和她的团队攻克了锂空气电池开发中的技术难关。锂空气电池工作原理示意图如下。下列说法正确的是
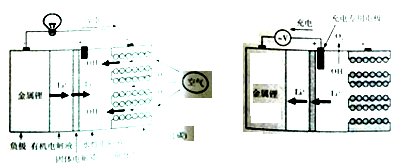
A.放电时,负极反应式为O2+4e-+2H2O=4OH-
B.充电时,阳极反应式为Li++e-=Li
C.电池充电反应为4LiOH=4Li+O2+2H2O
D.放电时消耗2molO2,转移电子数为4mol
查看答案和解析>>
科目: 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O3)是常用的食品抗氧化剂之一,在空气中被氧化生成的产物为Na2SO4.某小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置II中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5
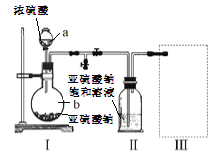
(1)仪器a、b的名称分别是_________、__________。
(2)装置I中产生气体的化学方程式为__________。
(3)要从装置II中获得已析出的晶体,可采用的分离方法是__________,该方法用到的玻璃仪器除烧杯、漏斗还需___________。
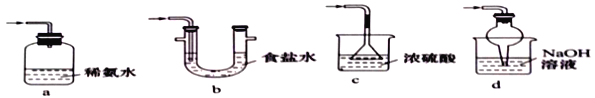
(4)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为_________(填序号)。
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3
(5)NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是_________(填序号)。
A.测定溶液的pH
B.加入Ba(OH)2溶液
C.加入盐酸
D.加入品红溶液
E.用蓝色石蕊试纸检测
(6)检验Na2S2O5晶体在空气中已被氧化的实验方案是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com