
科目: 来源: 题型:
【题目】某同学通过以下装置测定M 样品(只含Fe、Al、Cu)中各成分的质量分数。取两份质量均为m g 的M 样品,按实验1(如图1)和实验2(如图2)进行实验,该同学顺利完成了实验并测得气体体积分别为V1 mL 和V2 mL(已折算到标准状况下)。

(1)实验1 装置中小试管的作用是_______________。
(2)对于实验2,平视读数前应依次进行的两种操作是:
①______________;②________________________。
(3)实验1 进行实验前,B 瓶中水没有装满,使测得气体体积_____ (填“偏大”、“偏小”或“无影响”,下同);若拆去实验2 中导管a,使测得气体体积_____________。
(4)该实验需要0.50 mol·L-1 的NaOH 溶液470 mL,请回答下列问题
①配制时应称量______g NaOH,配制过程所需仪器____________ (填仪器名称)。
②配制NaOH 溶液时,NaOH 固体中含有Na2O 杂质会导致所配溶液浓度________。(填“偏大”、“偏小”或“无影响”)。
(5)该实验中所用稀硫酸是用98%的浓硫酸(ρ =1.84g/cm3)配制的,若将该浓硫酸与等质量的水混合,则所得溶液中溶质物质的量浓度_________9.2mol/L(填>、<、=)
查看答案和解析>>
科目: 来源: 题型:
【题目】右表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题
(1)Z元素在周期表中的位置为__________。
(2)表中元素原子半径最大的是(填元素符号)__________。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________;
A.Y单质与H2S溶液反应,溶液变浑浊
B.在氧化还原反应中,1molY单质比1molS得电子多
C.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,Q与水反应的化学方程式为 。
(5)联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,联氨分子的电子式为①_____________,其中氮的化合价为②___________,实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为③ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是( )
选项 | 操作 | 现象 | 结论 |
A. | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉溶液后溶液变蓝色 | 氧化性:Cl2>I2 |
B. | 将可调节高度的铜丝伸入稀硝酸中 | 溶液变蓝 | 铜与稀硝酸发生置换反应 |
C. | 向溶液X中滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X中一定含有SO42- |
D. | 常温下将铝片放入浓硝酸中 | 无明显现象 | 铝与浓硝酸不反应 |
查看答案和解析>>
科目: 来源: 题型:
【题目】下列除去杂质的操作中错误的是
A.除去石英中少量的碳酸钙:用稀盐酸溶解后过滤
B.FeCl2溶液中混有的FeCl3:加入过量的铁粉充分反应后过滤
C.除去氢氧化铁胶体中的铁离子用渗析的方法
D.氯气混有少量氯化氢气体:将混合气体通过盛NaOH溶液的洗气瓶
查看答案和解析>>
科目: 来源: 题型:
【题目】邻羟基桂皮酸是合成香精的重要原料,下为合成邻羟基桂皮酸的路线之一
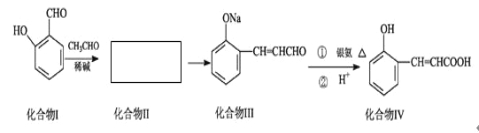
已知:
试回答下列问题:
(1)化合物II的结构简式为: 。
(2)化合物II→化合物III的有机反应类型 。
(3)化合物III在银氨溶液中发生反应化学方程式 。
(4)有机物X为化合物IV的同分异构体,且知有机物X有如下特点:①是苯的对位取代物,②能与NaHCO3反应放出气体,③能发生银镜反应。请写出化合物X的结构简式 。
(5)下列说法正确的是( )
A. 化合物I遇氯化铁溶液呈紫色
B. 化合物II能与NaHCO3溶液反应
C. 1mol化合物IV完全燃烧消耗9.5molO2
D. 1mol化合物III能与3 mol H2反应
(6)有机物R(C9H9ClO3)经过反应也可制得化合物IV,则R在NaOH醇溶液中反应的化学方程式为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】某反应在体积为5L的恒容密闭的绝热熔器中进行,在0~3分钟内各物质的量的变化情况如图所示(已知A、B、C均为气体)。

(1)该反应的化学方程式为____________________________________。
(2)反应开始至2分钟时,B的平均反应速率为__________________。
(3)能说明该反应已达到平衡状态的是
A.V(A)=2V(B) B.容器内气体密度不变
C.V逆(A)=V正(C) D.容器内温度不变
(4)由图求得平衡时A的转化率为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)氧化—还原法消除氮氧化物的转化如下:![]()
①反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是_____。
(2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g)![]() SO3(g)+NO(g) △H=-41.8 kJ·mol-1
SO3(g)+NO(g) △H=-41.8 kJ·mol-1
已知:2SO2(g)+O2(g)![]() 2SO3(g) △H=-196.6 kJ·mol-1,写出NO和O2反应生成NO2的热化学方程式 。
2SO3(g) △H=-196.6 kJ·mol-1,写出NO和O2反应生成NO2的热化学方程式 。
(3)尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料。
①以尿素为原料一定条件下发生反应:CO(NH2)2 (s) + H2O(l)![]() 2 NH3(g)+CO2(g) △H = +133.6 kJ/mol。该反应的化学平衡常数的表达式K= 。关于该反应的下列说法正确的是 (填序号)。
2 NH3(g)+CO2(g) △H = +133.6 kJ/mol。该反应的化学平衡常数的表达式K= 。关于该反应的下列说法正确的是 (填序号)。
a.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中增加水的用量可使该反应的平衡常数增大
c.降低温度使尿素的转化率增大
②密闭容器中以等物质的量的NH3和CO2为原料,在120 ℃、催化剂作用下反应生成尿素:CO2(g) +2NH3(g)![]() CO (NH2)2 (s) +H2O(g),混合气体中NH3的物质的量百分含量[(NH3)]随时间变化关系如图所示。则a点的正反应速率V(正)(CO2) b点的逆反应速率V(逆)(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是 。
CO (NH2)2 (s) +H2O(g),混合气体中NH3的物质的量百分含量[(NH3)]随时间变化关系如图所示。则a点的正反应速率V(正)(CO2) b点的逆反应速率V(逆)(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是 。

查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述不正确的是
A. 1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
B. 0.1 mol H2O中含有电子的数目为NA
C. 标准状况下,11.2 L四氯化碳中含有分子的数目为0.5NA
D. 0.5 mol ·L-1CaCl2溶液中的Cl—的数目为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com