
科目: 来源: 题型:
【题目】某Na2CO3、NaAlO2的混合溶液中逐滴加入1molL-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是( )

A.原混合溶液中的CO2-3与AlO-2的物质的量之比为1:2
B.V1:V2=1:5
C.M点时生成的CO2为0.05mol
D.a曲线表示的离子方程式为:AlO-2+H++H2O=Al(OH)3↓
查看答案和解析>>
科目: 来源: 题型:
【题目】某Cr2O3样品中含有少量Al2O3、MgO等杂质。实验室以此样品为主要原料制取重铬酸钾(K2Cr2O7)的流程如下:
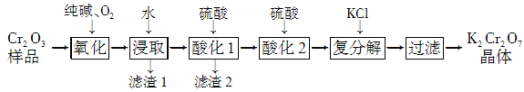
已知:2CrO42-+2H+![]() Cr2O72-+H2O。
Cr2O72-+H2O。
(1) 上述氧化过程中,若将1 mol Cr2O3转化成Na2CrO4,消耗氧气的体积(标准状况)是________。
(2) 酸化1中为确保溶液中Al3+、AlO2-浓度均不超过10-6 mol·L-1,需调节溶液pH的范围是________。
已知:Al(OH)3(s) ![]() H++AlO2-+H2O的K=1×10-14;Ksp[Al(OH)3]=1×10-33
H++AlO2-+H2O的K=1×10-14;Ksp[Al(OH)3]=1×10-33
(3)酸化2后所得溶液加入KCl发生复分解反应,该反应能发生的原因是_________________。
(4) 称取重铬酸钾试样2.40 g 配成250 mL溶液,取出25.00 mL于碘量瓶中,加入稀硫酸和足量碘化钾(铬被还原为Cr3+)并放于暗处6min左右,然后加入适量水和数滴淀粉指示剂,用0.24 mol·L-1 Na2S2O3标准溶液滴定至终点(发生反应:I2+2S2O32-===2I-+S4O62-,杂质不参与反应),共用去Na2S2O3标准溶液20.00mL。求所得产品中重铬酸钾的质量分数(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定质量含Cu、Cu2O、和CuO的固体混合物,将其分成两等份并进行下列转化:
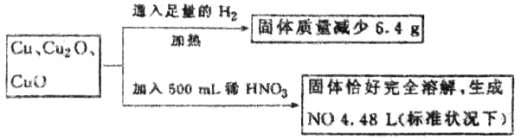
则转化过程中所加稀HNO3的物质的量浓度为( )
A.3.2mol/L B.3.6mol/L C.4.0mol/L D.4.4mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】两种气态烃组成的混合气体0.1mol,完全燃烧得0.16molCO2和3.6gH2O,下列说法正确的是( )
A.一定有甲烷 B.一定有甲烷和乙烯
C.一定没有乙烯 D.一定有乙炔
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钠大量用于染料和有机合成工业。用木屑制备亚硝酸钠的流程如下:
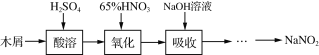
已知氧化过程中,控制反应液的温度在55~60℃条件下发生的主要反应为:
C6H12O6+12HNO3==3H2C2O4+9NO2↑+3NO↑+9H2O
(1)酸溶过程中,硫酸的作用是 。吸收完成后,将吸收液蒸发浓缩、冷却结晶、过滤、洗涤得到白色晶状的亚硝酸钠。
(2)实验室模拟氧化和吸收过程的装置如右图所示,A装置须控制反应液的温度不高于60℃的原因是 ;B装置用于制备亚硝酸钠,其中盛放的溶液是 (填字母)。
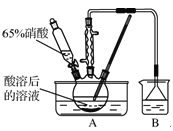
a.NaCl溶液 b.Na2CO3溶液 c.NaNO3溶液
(3)工业上在吸收过程中需控制NO和NO2的物质的量比接近1∶1。若(NO)∶n(NO2)>1∶1,则会导致 ;若n(NO)∶n(NO2)<1∶1会使产品中混有的杂质为 。
(4)已知NaNO2能把酸性条件下的Fe2+氧化,同时产生一种有毒的气体,请写出该反应的离子方程式: 。
(5)已知:①NaNO2有氧化性,在酸性条件下能把I-氧化为I2;S2O又能把I2还原为I-。②NaNO2也有还原性,能使酸性KMnO4溶液褪色。为测定产品NaNO2的纯度,请补充完整实验方案:准确称量适量的NaNO2样品放入锥形瓶中,加适量水溶解, 。
实验中可供选择的试剂:
稀硫酸、c1 mol·L-1 KI溶液、淀粉溶液、c2 mol·L-1 Na2S2O3溶液、c3 mol·L-1酸性KMnO4溶液。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素。X原子的质子数与电子层数相同,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示。下列说法不正确的是
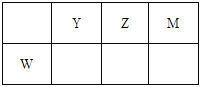
A. 原子半径:W>Y>Z>M>X
B. 热稳定性:XM>X2Z,沸点:X2Z>YX3
C. X、Y、Z三种元素形成的化合物中不可能含离子键
D. ZM2、YM3、WM4分子中每个原子最外层均满足8电子结构
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车的启动电源常用铅蓄电池。其结构如下图所示,放电时的电池反应如下:
PbO2+Pb+2H2SO4===2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )

A.PbO2是电池的负极
B.SO42-向Pb极移动
C.PbO2得电子,被氧化
D.电池放电时,溶液酸性增强
查看答案和解析>>
科目: 来源: 题型:
【题目】工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理:①Al4C3与硫酸反应可生成CH4。
②AlN溶于强酸产生铵盐,溶于强碱生成氨气。
写出Al4C3与硫酸反应的化学方程 。
(2)实验装置(如图所示):
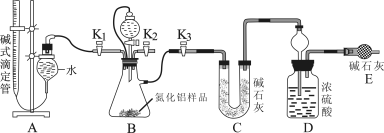
(3)实验过程:
①连接实验装置,检验装置的气密性。称得D装置的质量为yg,滴定管的读数为amL
②称取xgAlN样品置于装置B瓶中;塞好胶塞,关闭活塞K2、K3 ,打开活塞K1,通过分液漏斗加入稀硫酸,与装置B瓶内物质充分反应。
③待反应进行完全后,关闭活塞K1,打开活塞K3 ,通过分液漏斗加入过量NaOH ,与装置B瓶内物质充分反应。
④ (填入该步应进行的操作)。
⑤记录滴定管的读数为bmL,称得D装置的质量为zg。
(4)数据分析:(已知:该实验条件下的气体摩尔体积为Vm L·mol-1)
①Al4C3的质量分数为 。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积 (填“偏大”、“偏小”或“无影响”下同)。若分液漏斗和吸滤瓶间没有用橡胶管连通,则所测气体的体积 。
③AlN的质量分数为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】以下关于甲烷的说法中错误的是
A. 甲烷分子具有正四面体结构
B. 甲烷化学性质比较稳定,不被任何氧化剂氧化
C. 甲烷分子中具有极性键
D. 甲烷分子中四个C—H键是完全等价的键
查看答案和解析>>
科目: 来源: 题型:
【题目】T3℃时,将A、B、C三种物质分别溶于100克水中,制成饱和溶液。这三种物质的溶解度随温度而变化的曲线如右图。从T3降至T1,下列有关说法正确的是
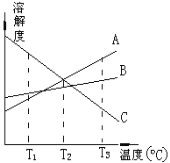
A.T3℃时,由A物质所形成的溶液的物质的量浓度最大
B.T2℃时,由A、C两物质形成的溶液质量分数相等
C.T1℃时,由B物质所形成的溶液质量分数最大,C的最小
D.从溶解度曲线可知分离A、C的混合溶液得到A可采用蒸发结晶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com