
科目: 来源: 题型:
【题目】下列物质的除杂方案正确的是
选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
A | CO2(g) | SO2(g) | 饱和Na2CO3溶液、浓H2SO4 | 洗气 |
B | NH4Cl(ap) | Fe3+(ap) | NaOH溶液 | 过滤 |
C | NaCl(s) | KNO3(g) | AgNO3溶液 | 过滤 |
D | Cu(s) | Ag(s) | CuSO4 | 电解法 |
查看答案和解析>>
科目: 来源: 题型:
【题目】以乙炔为原料通过以下流程能合成有机物中间体D。
![]()
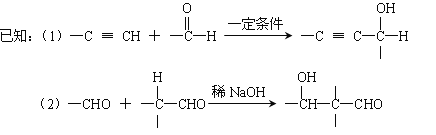
请回答下列问题:
(1)化合物D的分子式为 ,写出D的官能团的名称 。
(2)写出生成A的化学反应方程式: 。
(3)化合物B在浓硫酸催化下,加热与HOOCCOOH反应生成环状酯的化学方程式为: (注明条件)。
(4)化合物C的结构简式为: 。
(5)已知1mol HCHO和1mol CH3CH2CHO发生类似已知(2)的反应,生成1molE。以下关于E的说法正确的是 。
a、E能与H2发生加成反应,也能使酸性高锰酸钾溶液褪色。
b、E属于酯类物质。
c、1molE完全燃烧消耗5molO2.。
d、生成E的反应属于取代反应。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知红磷通常要比白磷稳定,下列两个反应:
①P4(白磷,s)+5O2(g)=2P2O5(s) △H1
②4P(红磷,s)+5O2(g)=2P2O5(s) △H2
则△H1和△H2的关系是
A.△H1=△H2 B.△H1>△H2 C.△H1<△H2 D.无法确定
查看答案和解析>>
科目: 来源: 题型:
【题目】完成原电池问题。
Ⅰ.有甲、乙两位同学均想利用原电池反应检测金属的活动性,两人均使用相同镁片与铝片作电极,甲同学将电极放入2 mol/L H2SO4 溶液中,乙同学将电极放入2 mol/L的NaOH溶液中,如图所示。

请回答:
(1)写出甲池中正极的电极反应式: 。
(2)写出乙池中负极的电极反应式和总反应的离子方程式:
负极: ;
总反应: 。
(3)如果甲、乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出______ 活动性更强,而乙会判断出______ 活动性更强(填写元素符号)。
(4)由此实验,可得到如下哪些正确结论?_________(填写字母序号)。
a.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b.镁的金属性不一定比铝的金属性强
c.该实验说明金属活动性顺序已过时,已没有实用价值
d.上述实验反过来证明了“直接利用金属活动性顺序判断原电池中的正负极”的做法是“不可靠”的
Ⅱ.市场上出售的“热敷袋”其主要成分是铁屑、炭粉、木屑和少量氯化钠、水等。“热敷袋”启用之前用塑料袋使其与空气隔绝,启用时,打开塑料袋轻轻揉搓就会放出热量。使用完后,会发现有大量铁锈存在。“热敷袋”放出的热量是利用了 而放出热量。
查看答案和解析>>
科目: 来源: 题型:
【题目】CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示。下列结论错误的是

A.反应开始2 min内平均反应速率最大
B.反应4~6 min内平均反应速率最小
C.反应开始4 min内温度对反应速率的影响比浓度大
D.反应在第2 min到第4 min间生成CO2 的平均反应速率最大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于有机物的叙述正确的是
A. 乙醇不能发生取代反应 B. C4H10有三种同分异构体
C. 氨基酸、淀粉均属于高分子化合物 D. 乙烯和甲烷可用溴的四氯化碳溶液鉴别
查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿伏伽德罗常数。下列说法正确的是( )
A.7.8gNa2O2中含有的阴离子数目为0.2NA
B.1mol苯乙烯中含有的碳碳双键数为4NA
C.1molNaCl固体中含有NA个Na+
D.28g乙烯分子中含有极性共价键的数目为6NA
查看答案和解析>>
科目: 来源: 题型:
【题目】某工业废水中含有CN-和Cr2O72-等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理,回答下列问题:
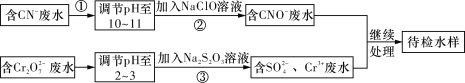
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为:_________________。
(2)步骤③的反应为S2O32-+Cr2O72-+H+―→SO42-+Cr3++H2O(未配平),则每消耗0.4 mol Cr2O72-转移________mol e-。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是_________________。
(4)在25 ℃下,将a mol·L-1的NaCN溶液与0.01 mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a__________0.01(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=______________________。
(5)取工业废水水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀。该过程中反应的离子方程是:___________________,___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学查阅教材上的溶解性表时发现,CuCO3对应的为“—”,表示不存在或遇水就分解。已知铜离子的常见沉淀为Cu(OH)2(蓝色)、Cu2(OH)2SO4(蓝色)、Cu2(OH)2CO3(绿色)等,它们均不含结晶水。为了探究CuSO4和Na2CO3反应产物的成份,该同学按以下实验方法制备了两种沉淀,并设计了探究沉淀成份的实验。
取2个小烧杯和2个锥形瓶,在每个烧杯里加入50mL0.5mol/L的CuSO4溶液,在锥形瓶里分别加入40mL 和50mL0.5mol/LNa2CO3溶液,置于70℃水中水浴加热,然后将CuSO4溶液加入到Na2CO3溶液中,继续水浴,均有气泡产生,几分钟后分别得到蓝绿色和绿色沉淀。过滤、洗涤、干燥,得到两份固体。
I.对蓝绿色沉淀成份的探究。
通过右边实验证实,沉淀中含有Cu2(OH)2CO3和Cu2(OH)2SO4

(1)证明有Cu2(OH)2CO3存在的现象为____________;
(2)试剂①为__________,证明有Cu2(OH)2SO4存在的现象为______________。
II.对绿色沉淀成份的探究
重复I实验,发现没有SO42-存在,有Cu2(OH)2CO3存在;
通过下列实验证实,沉淀中只有Cu2(OH)2CO3

(3)该同学想通过测量固体分解所得气体的质量来确定沉淀的成份,按上述思路组装好装置,加入相应的药品,并指出所加药品的目的。

(4)按照该同学的设计思路,只需测定某两个装置的质量变化,即△m (_______):△m(_______)=_______时(括号中填写装置的序号)就可确定固体是Cu2(OH)2CO3。
(5)结论:n(Cu2+):n(CO32-)>1时,所得固体产物有Cu2(OH)2CO3和Cu2(OH)2SO4 ;n(Cu2+):n(CO32-)≤1时,所得固体产物全部是Cu2(OH)2CO3,生成该沉淀发生反应的离子方程式为:____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下图判断,下列说法正确的是( )

A. 装置Ⅰ和装置Ⅱ中负极反应均是Fe-2e-Fe2+
B. 装置Ⅰ和装置Ⅱ中正极反应均是O2+2H2O+4e-4OH-
C. 装置Ⅰ和装置Ⅱ中盐桥中的阳离子均向右侧烧杯移动
D. 放电过程中,装置Ⅰ左侧烧杯和装置Ⅱ右侧烧杯中溶液的pH均增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com