
科目: 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如下表。甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素。下列判断正确的是( )
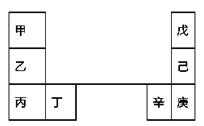
A. 乙的单质在空气中燃烧生成只含离子键的化合物
B. 原子半径:庚>辛>戊
C. 金属性:甲>乙>丁
D. 丙和庚的原子核外电子数相差13
查看答案和解析>>
科目: 来源: 题型:
【题目】固体碘化铵置于密闭容器中,加热至一定温度后恒温,容器中发生反应:①NH4I(s)![]() NH3(g)+HI(g) ②2HI(g)
NH3(g)+HI(g) ②2HI(g)![]() H2(g)+I2(g),测得平衡时c(I2)=0.5mol/L,反应①的平衡常数为20mol2/L2,则下列结论不正确的是
H2(g)+I2(g),测得平衡时c(I2)=0.5mol/L,反应①的平衡常数为20mol2/L2,则下列结论不正确的是
A.平衡时c(NH3)=5mol/L
B.平衡时HI分解率为20%
C.混合气体的平均摩尔质量不再发生变化不可以作为判断该反应达到平衡状态的标志
D.平衡后缩小容器体积,NH4I的物质的量增加,I2的物质的量不变
查看答案和解析>>
科目: 来源: 题型:
【题目】现有如下溶液:
①1.0mL0.10molL-1双氧水
②1.0mL0.20molL-1双氧水
③3.0mL0.10molL-1KMnO4溶液
④3.0mL0.010molL-1KMnO4溶液。
所有实验均需加入1.0mL稀硫酸(足量),依据褪色时间长短判定反应速率快慢:
(1)写出发生反应的离子方程式_________________________;若某反应的化学方程式为2KMnO4+9H2O2+3H2SO4=K2SO4+2MnSO4+7O2↑+12H2O,则该反应的氧化剂为______________,若有9molH2O2参加该反应,则反应转移电子数目为___________;
(2)某温度下,若要探究反应物浓度对反应速率的影响,则应选择试剂______进行实验(填序号)。
(3)某温度下,某同学按照(2)中选择试剂进行实验,褪色时间为5s:
①计算以H2O2表示的反应速率为___________;
②进行实验过程中,该同学发现颜色变化会出现先慢后快并突然褪色的现象。为此该同学又进行了一次平行实验,只是加入少量MnSO4固体,结果溶液立即褪色,请推测颜色变化会出现先慢后快并突然褪色的现象的原因___________;
(4)某同学在不同温度下,分别取两份等体积不同浓度的双氧水与等量KMnO4溶液进行反应,绘制出c(H2O2)随时间(t)变化的曲线如图所示,若A、B分别为不同温度时测定的曲线,则_____(填“A”或“B”)曲线所对应的实验温度高,判断的依据是___________;
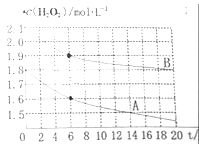
查看答案和解析>>
科目: 来源: 题型:
【题目】某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,关于该元素的说法正确的是( )
A. 在自然界中既有化合态又有游离态
B. 单质常用作半导体材料
C. 气态氢化物很稳定
D. 最高价氧化物不与任何酸反应,可制光导纤维
查看答案和解析>>
科目: 来源: 题型:
【题目】化学是与社会、环境等密切相关。下列有关说法中正确的是
A.发展“低碳经济”能够减少对化石能源的依赖
B.人造纤维、合成橡胶和光导纤维都属于有机高分子化合物
C.LED光源中的氮化镓(GaN)熔点为1700℃,属分子晶体
D.甲型H1N1流感病毒的蛋白质由C、H、O三种元素组成
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E是中学化学常见单质,X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(反应物和产物中的H2O已略去):
(1)Y的电子式为 ,构成E单质的元素在周期表中位于第 周期第 族。
(2)反应①的离子方程式为 反应②的离子方程式为 反应③的离子方程式为
(3)某工厂用C制漂白粉。
①写出制漂白粉的化学方程式
②为测定该工厂制得的漂白粉中有效成分的含量,某小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为 ,静置。待完全反应后,用0.1mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为 (保留到小数点后两位)。
查看答案和解析>>
科目: 来源: 题型:
【题目】[选修3:物质结构与性质]
根据元素周期表中第四周期元素的相关知识,回答下列问题:
(1)第四周期元素的基态原子的电子排布中4s轨道上只有1个电子的元素有____________种;写出Cu+的核外电子排布式____________。
(2)按电子排布,可将周期表里的元素划分成五个区域,第四周期元素中属于s区的元素有_________种,属于d区的元素有____________种。
(3)CaO晶胞如下图所示,CaO晶体中Ca2+的配位数为____________;
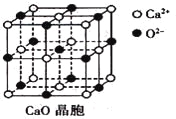
(4)由叠氮化钾(KN3)热分解可得纯N2:2KN3(s)=2K(l)+3N2(g),下列有关说法正确的是________(填选项字母)。
A.NaN3与KN3结构类似,前者晶格能较小 |
B.晶体钾的晶胞结构如图所示: |
C.氮的第一电离能大于氧 |
D.氮气常温下很稳定,是因为氮的电负性小 |
(5)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂。O2在其催化作用下,可将CN-氧化成CNO-。CN-的电子式为___________,CNO-的中心原子的杂化方式为___________。
(6)在CrCl3溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
[CrCln(H2O)6-n]x++xR-H→Rx[CrCln(H2O)6-n]+xH+。
将含0.0015mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol/LNaOH溶液25.00 mL,则该配离子的化学式为_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用NaOH固体和蒸馏水准确配制一定物质的量浓度的NaOH溶液,以下仪器中不需要用到的是( )
A. 烧瓶 B. 烧杯 C. 容量瓶 D. 玻璃棒
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下表中烃的分子式排列规律,判断空格中烃的分子式是( )
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
CH4 | C2H4 | C3H4 | C4H10 | C5H10 | C6H10 | C7H16 |
A.C7H18 B. C7H14 C.C8H18 D.C8H16
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com